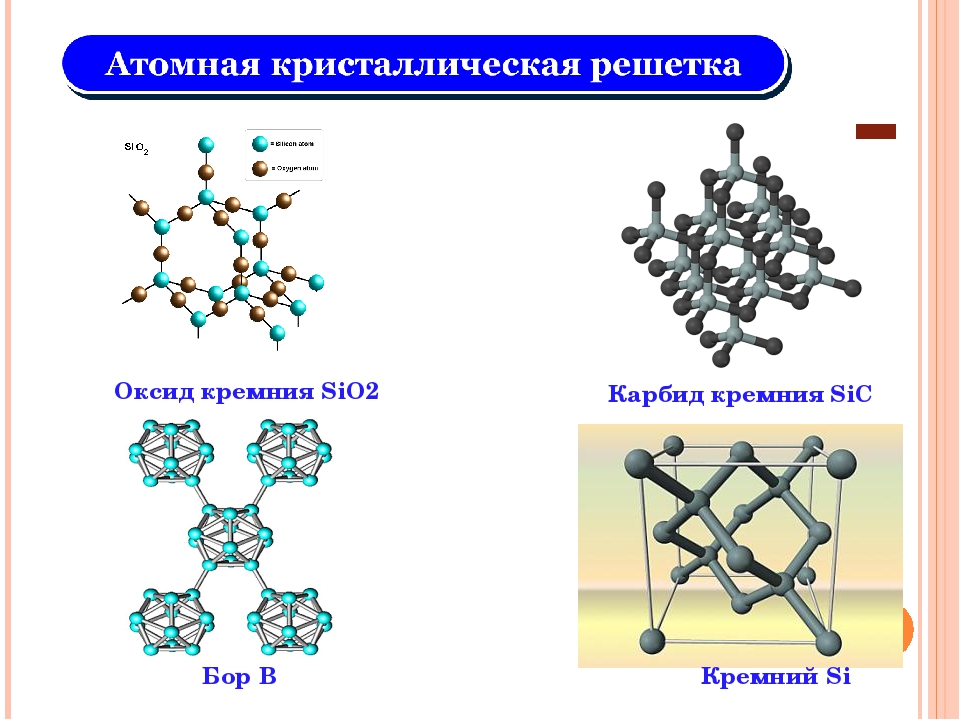
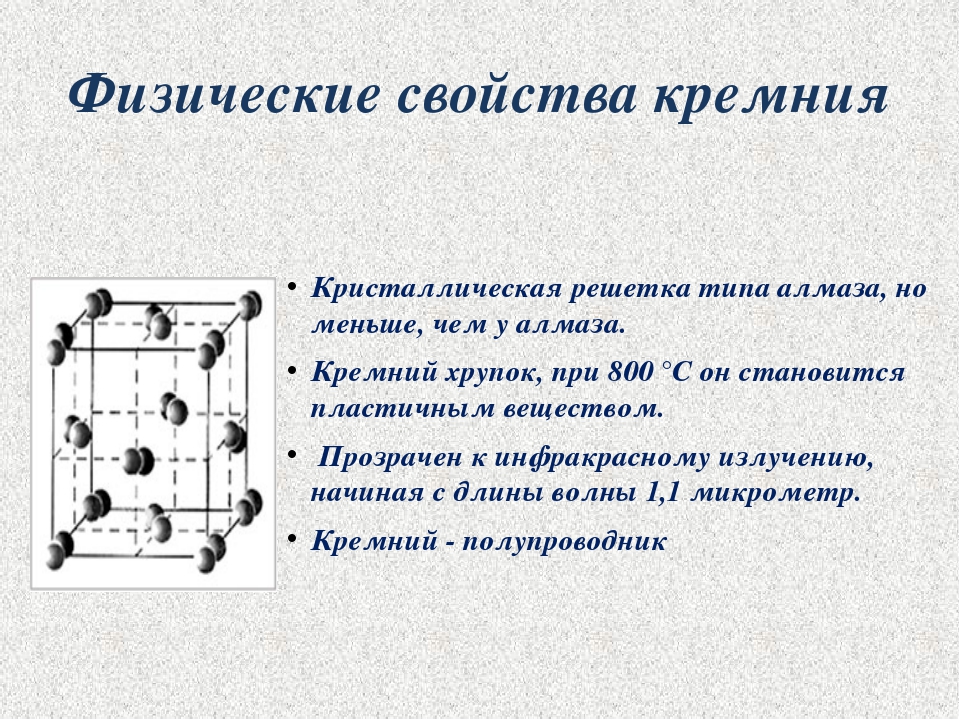
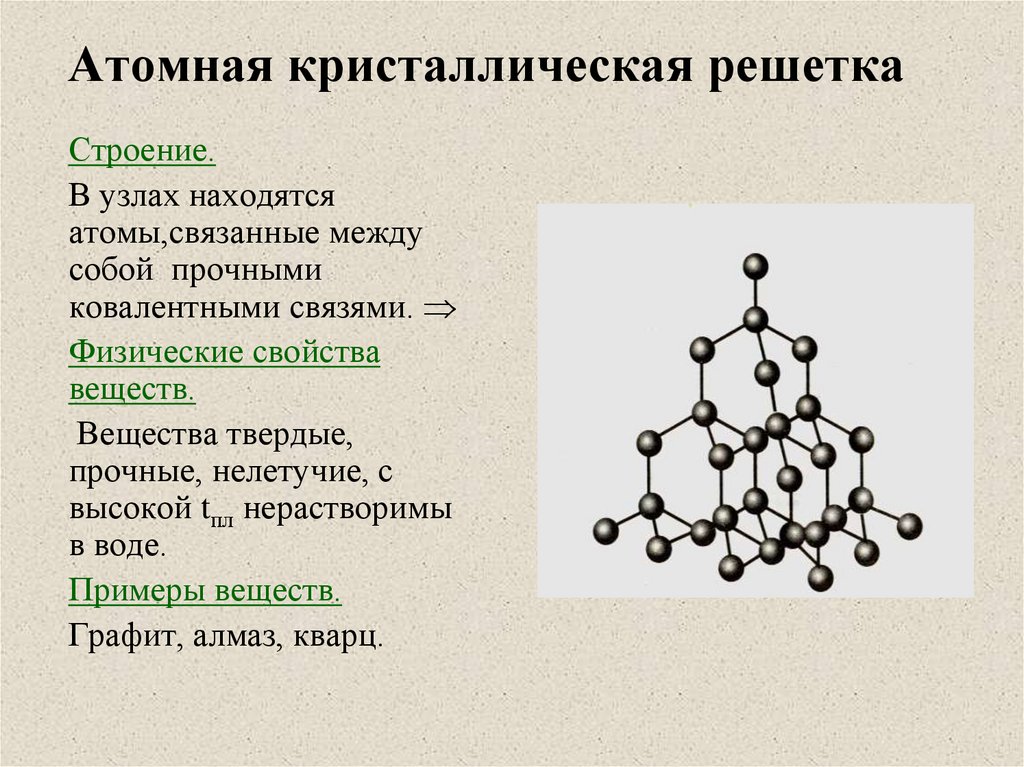
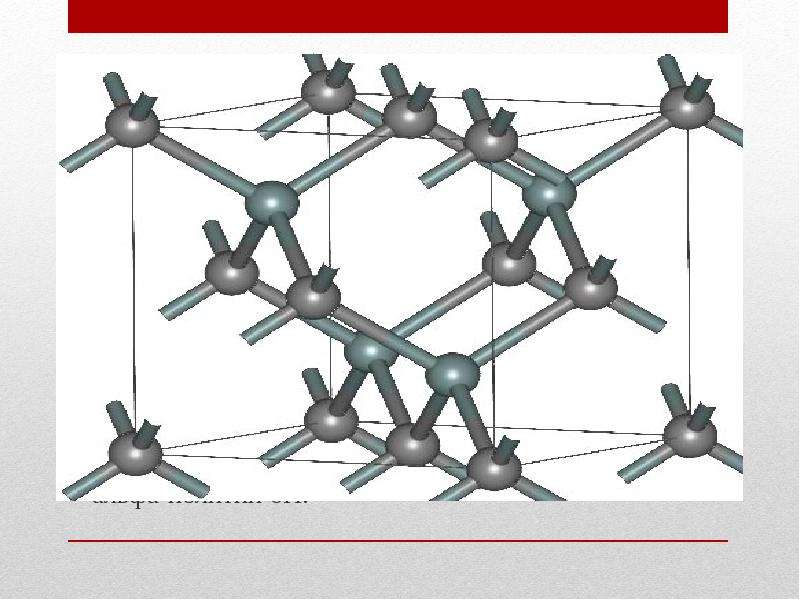
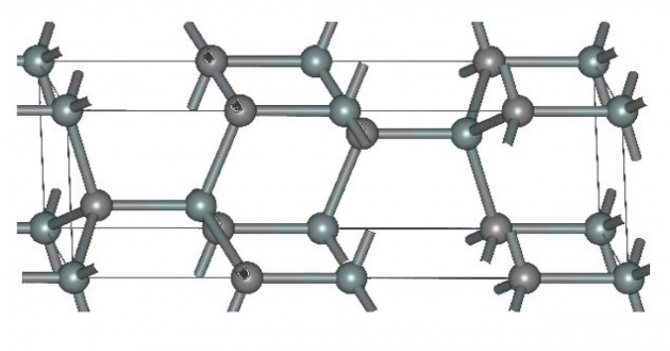
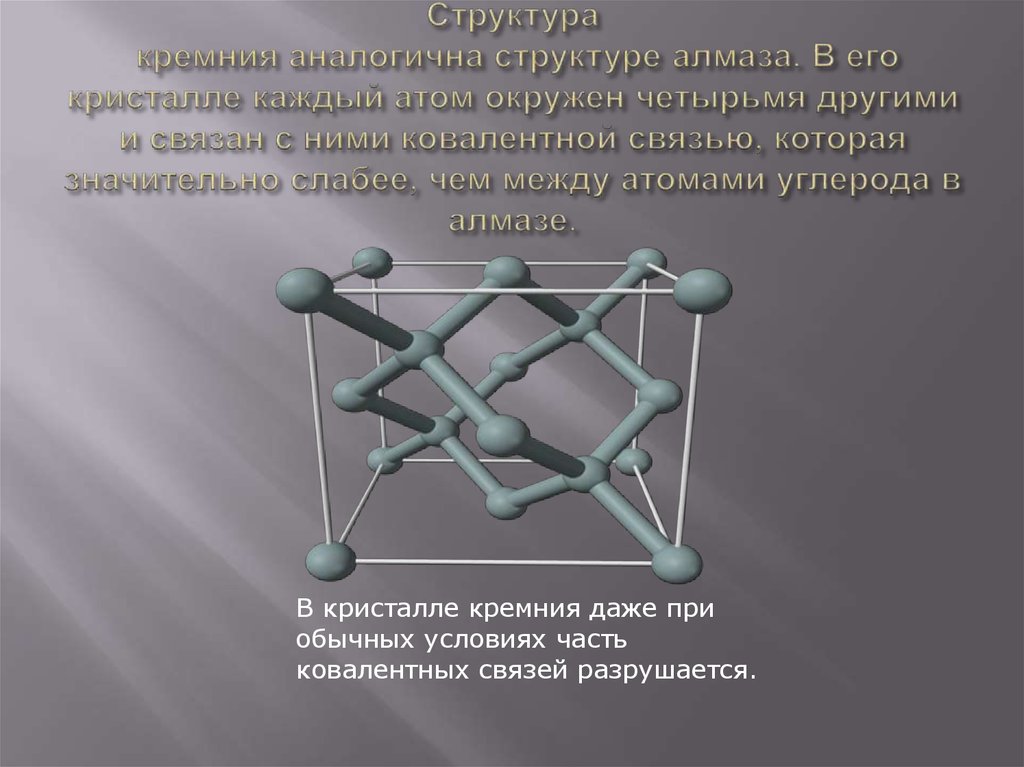
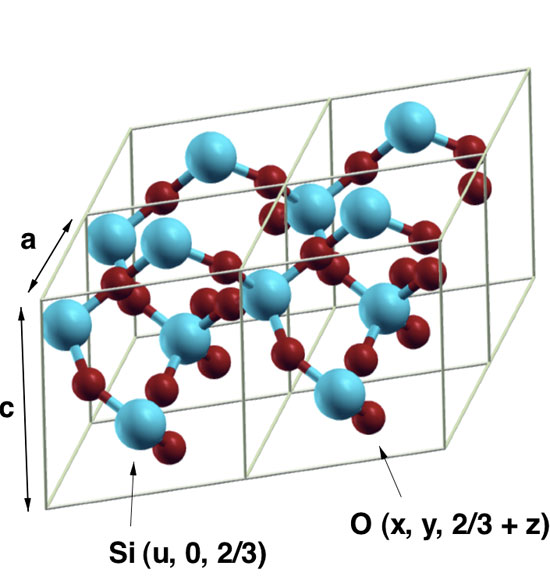
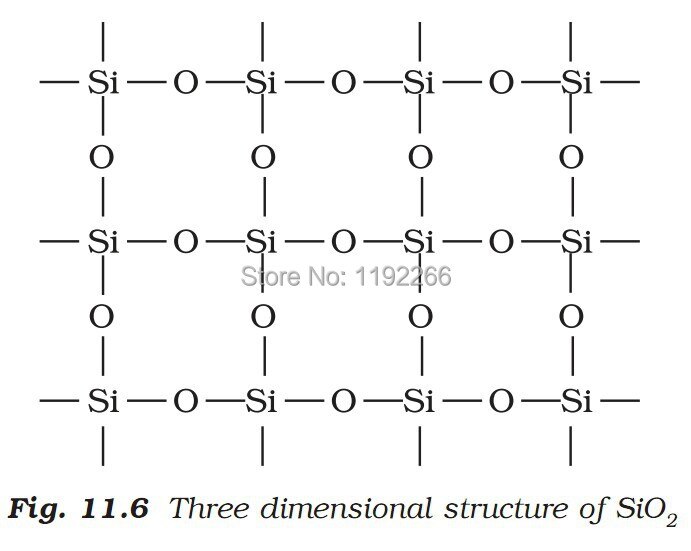
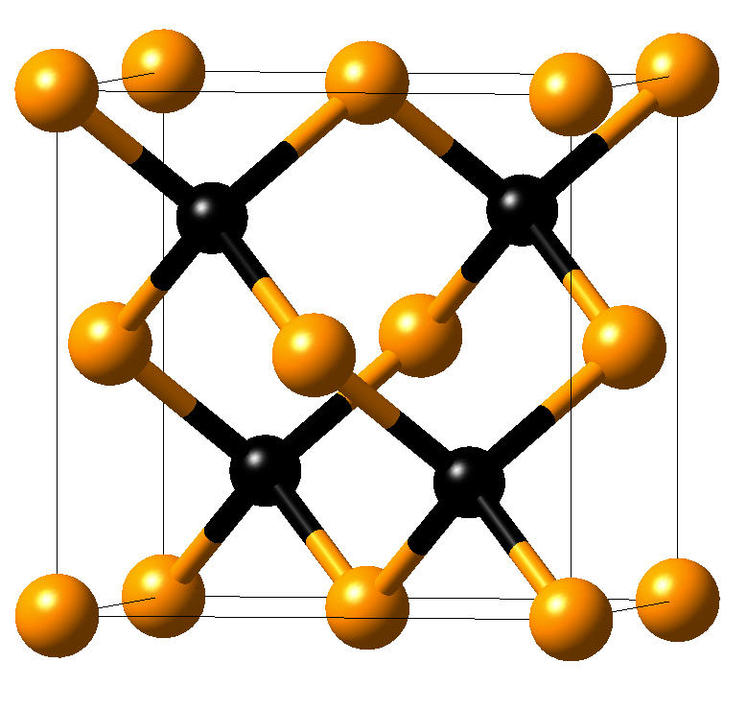
Физико-химические характеристики
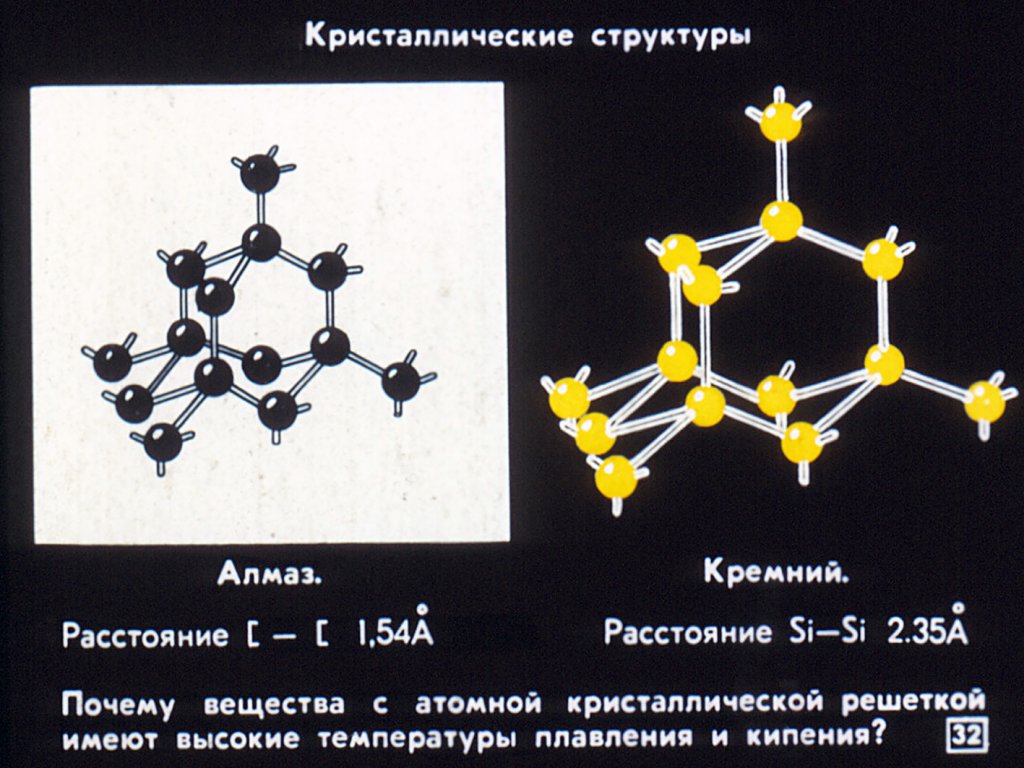
По химической классификации карборунд – это карбид кремния с простой формулой.

Тверже него только алмаз. Карборунд плотен, тугоплавок, равнодушен к истиранию, кислотам, прочим агрессивным веществам.
Карбид кремния:
- Плотность 3,05 г/см³.
- Состав 93 % карбида кремния.
- Предел прочности на изгиб 320…350 МПа.
- Предел прочности на сжатие 2300 МПа.
- Модуль упругости 380 ГПа.
- Твердость 87…92 HRC.
- Трещиностойкость в пределах 3.5 — 4.5 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 140—200 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 3,5…4,0 К−1⋅10−6.
- Вязкость разрушения 3,5 МПа·м1/2.
Самосвязанный карбид кремния:
- Плотность 3,1 г/см³.
- Состав 99 % карбида кремния.
- Предел прочности на изгиб 350—450 МПа.
- Предел прочности на сжатие 2500 МПа.
- Модуль упругости 390—420 ГПа.
- Твердость 90…95 HRC.
- Трещиностойкость в пределах 4 — 5 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 80 — 130 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 2,8…4 К−1⋅10−6.
- Вязкость разрушения 5 МПа·м1/2.
ВК6ОМ:
- Плотность 14,8 г/см³.
- Состав Карбид вольфрама.
- Предел прочности на изгиб 1700…1900 МПа.
- Предел прочности на сжатие 3500 МПа.
- Модуль упругости 550 ГПа.
- Твердость 90 HRA.
- Трещиностойкость в пределах 8-25 МПа·м1/2.
- Коэффициент теплопроводности при 100 °C, 75…85 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 4,5 К−1⋅10−6.
- Вязкость разрушения 10…15 МПа·м1/2.
Силицированный графит СГ-Т:
- Плотность 2,6 г/см³.
- Состав 50 % карбида кремния.
- Предел прочности на изгиб 90…110 МПа.
- Предел прочности на сжатие 300…320 МПа.
- Модуль упругости 95 ГПа.
- Твердость 50…70 HRC.
- Трещиностойкость в пределах 2-3 МПа·м1/2.
- Коэффициент теплопроводности при 10 °C, 100…115 Вт/(м·К).
- Коэфф. теплового расширения при 20-1000 °C, 4,6 К−1⋅10−6.
- Вязкость разрушения 3…4 МПа·м1/2.
Однако лучи света камень преломляет сильнее алмаза, по этому параметру сопоставим с муассанитом.
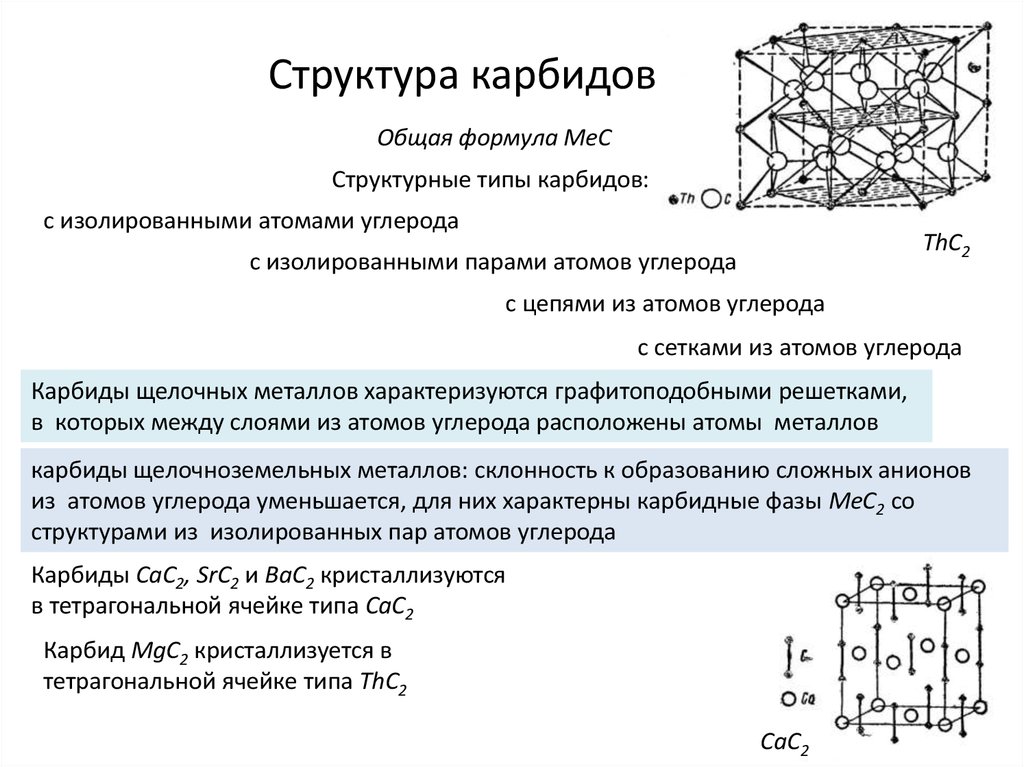
Разновидности карбидов
Различают несколько разновидностей карбидов в зависимости от конфигурации кристаллической решетки. Тип решетки определяет ряд физико-химических свойства материала, что нужно учитывать при их применении. Рассмотрим основные разновидности кристаллических решеток карбидов:
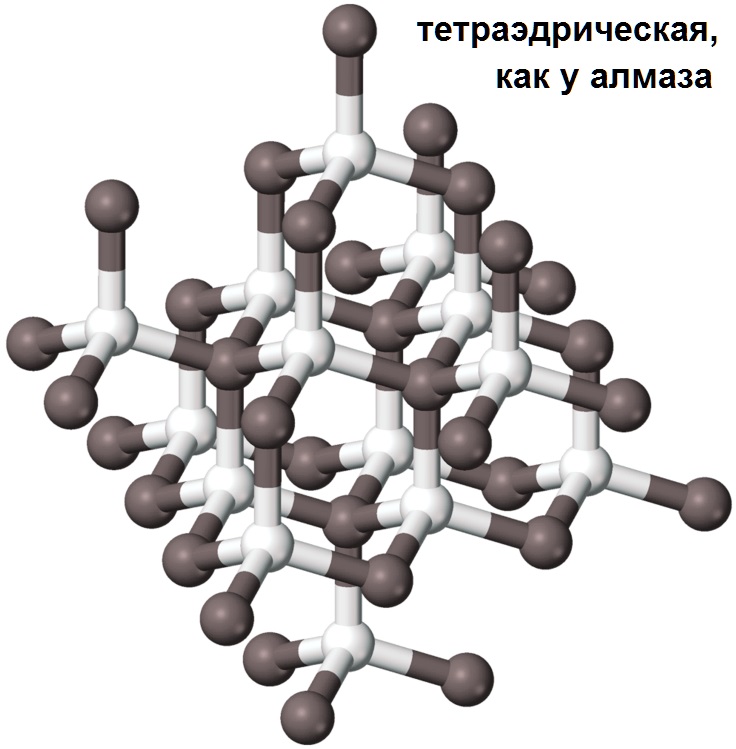
- Материалы с ковалентной решеткой. Вещества с таким способом связи возможны только в том случае, если в качестве второго элемента выступает бром или кремний. На атомарном уровне соединение образуется за счет sp, sp-2 или sp-3 гибридизации. В веществе атомарный металл заменяет собой углерод, что позволяет формировать прочное устойчивое вещество, которое устойчиво к механическим ударам, высоким температурам, химическим веществам. С точки зрения электропроводности вещество является полупроводником (хотя использование карбидов в качестве полупроводниковых элементов невыгодно с практической точки зрения).
- Металлоподобные материалы. В эту группу входят соединения, у которых металлических элемент является железом, кобальтом, никелем либо относится к переходной группе (IV-VII). У таких карбидных соединений металлические атомы располагаются не на месте атомов углерода, а в различных пустотах кристаллических решеток (поэтому часто такие вещества называют карбидами внедрения). Такое необычное расположение делает вещество устойчивым, крепким, надежным, оно не будет разрушаться под воздействием высоких температур или при воздействии химически активных веществ (кислоты, щелочи, соли и другие).
- Материалы с ионной связью. В эту группу входит множество карбидов, у которых в качестве металлического элемента выступает алюминий, редкоземельные металлы либо элементы I или II группы периодической таблицы. По химической структуре вещества похожи на соединения с ковалентной решеткой с той лишь разницей, что здесь металлы обычно теряют один или несколько электронов на внешнем уровне, что приводит к образованию веществ-ионов. По химико-физическим свойствам ионные карбиды аналогичны стандартным соединениям — отличная прочность, высокая температура плавления. Единственное крупное отличие — вещества активно взаимодействуют с кислотами (обычно с образованием металла или подобных веществ).

Применение и технические характеристики
Камень используется практически во всех отраслях жизни человека. Благодаря устойчивости и прочности этого минерала он необходим в строительстве. Он подходит для внутренней и наружной отделки помещений из камня, получаются хорошие предметы интерьера. Карборунд входит в состав дорожного покрытия. Его применяют при постройке автомобилей, в астрономии и электронике. Камень входит в состав тормоза для спортивных автомобилей, составных частей кузова бронированной техники, придавая ей прочности и выносливости. Из него изготавливают шлифовочные порошки, необходимые в изготовлении электроники и металлургии. Незаменимый этот минерал и в ювелирном деле. Его используют при производстве элитных ювелирных украшений и других драгоценностей. Благодаря свойствам полупроводника применяется как катализатор, он присутствует в светодиодах и лазерах.
Структура и свойства
 | ||
| (β) 3C-SiC | 4H-SiC | (α) 6H-SiC |
Карбид кремния, изображение, полученное под стереоскопическим микроскопом.
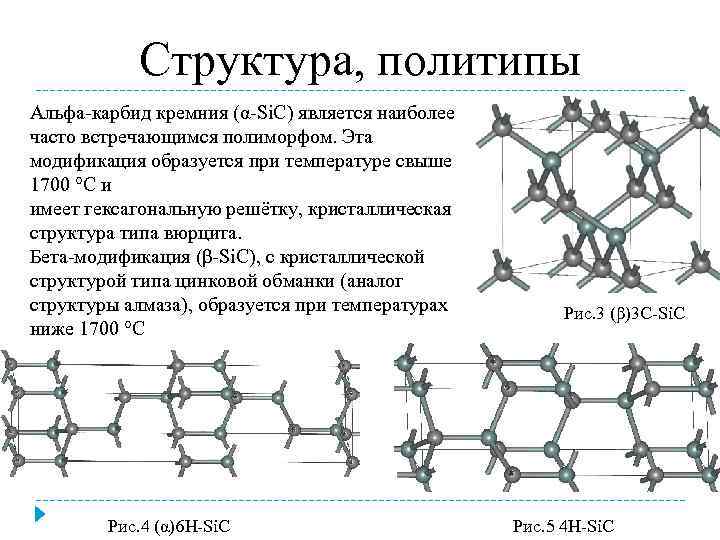
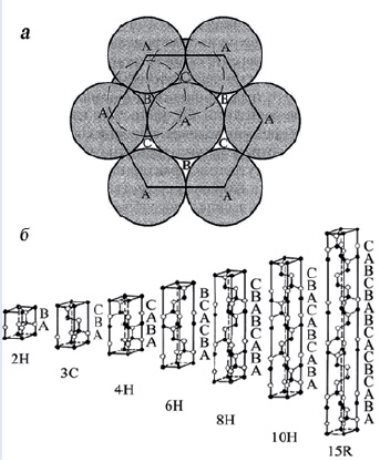
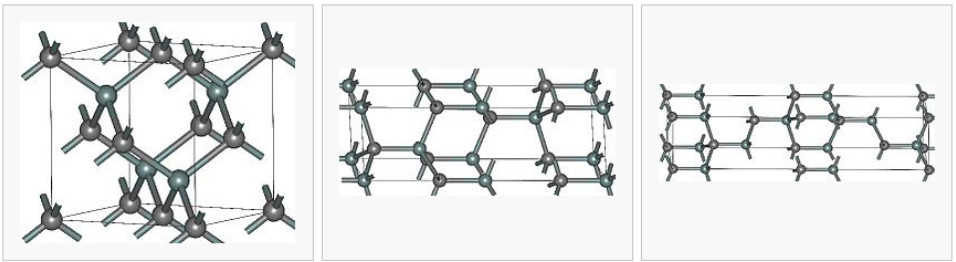
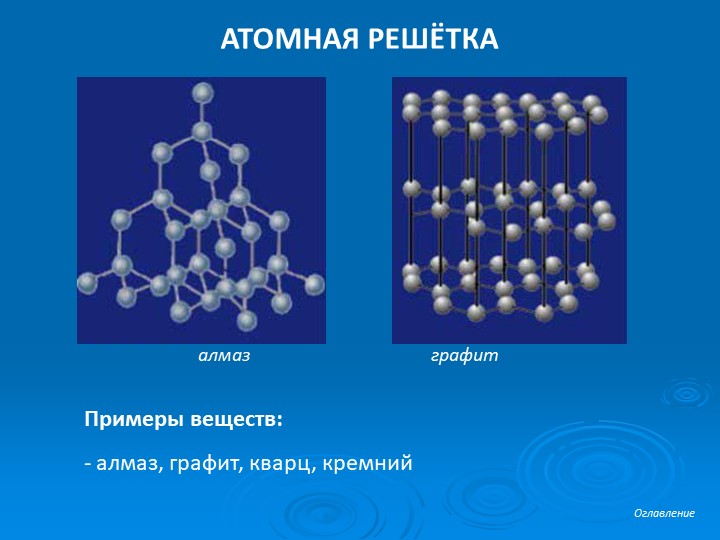
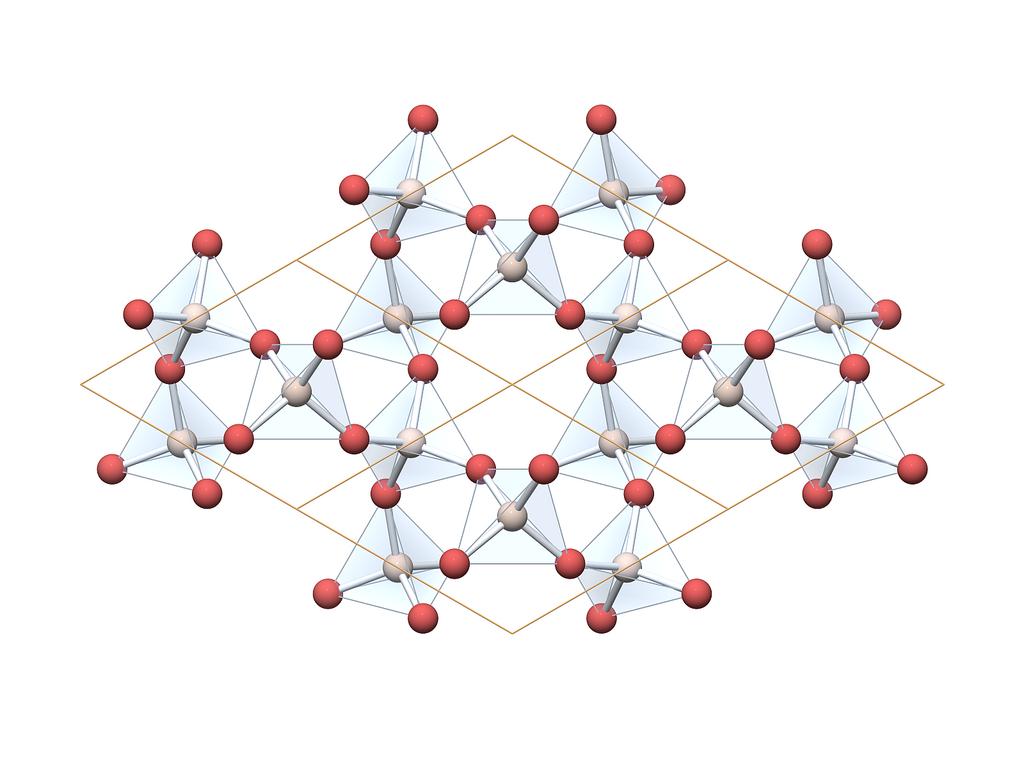
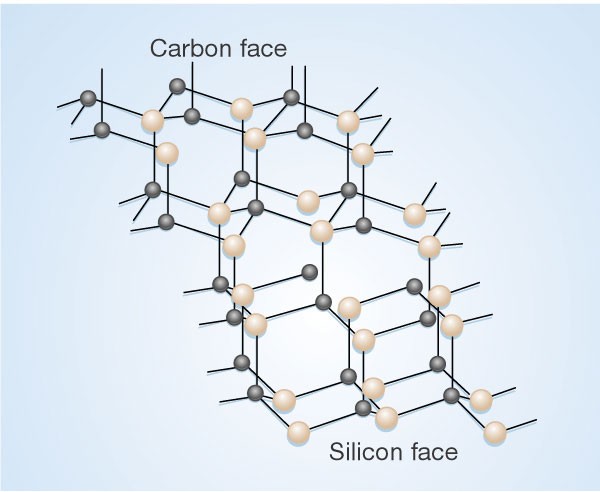
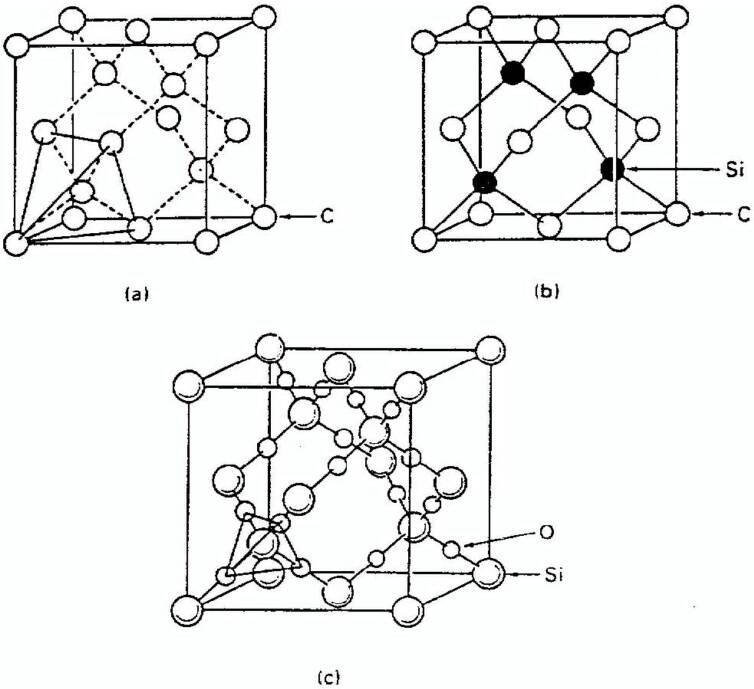
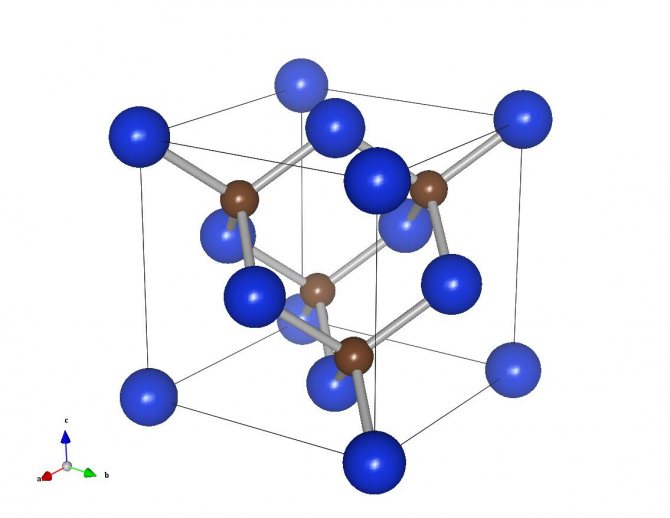
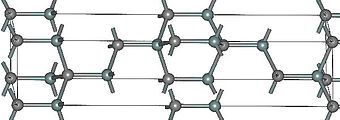
Карбид кремния существует примерно в 250 кристаллических формах. Путем пиролиза прекерамических полимеров в инертной атмосфере образуется также карбид кремния в стеклообразной аморфной форме. Полиморфизм SiC характеризуется большим семейством подобных кристаллических структур, называемых политипами. Это разновидности одного и того же химического соединения, которые идентичны в двух измерениях и различаются в третьем. Таким образом, их можно рассматривать как слои, уложенные в определенной последовательности.
Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом , образуется при температурах выше 1700 ° C и имеет гексагональную кристаллическую структуру (подобную вюрциту ). Бета-модификация (β-SiC) с кристаллической структурой цинковой обманки (подобной алмазу ) образуется при температурах ниже 1700 ° C. До недавнего времени бета-форма имела относительно немного коммерческих применений, хотя в настоящее время растет интерес к ее использованию в качестве носителя для гетерогенных катализаторов из-за ее большей площади поверхности по сравнению с альфа-формой.
| Политип | 3C (β) | 4H | 6H (α) |
|---|---|---|---|
| Кристальная структура | Цинковая обманка (кубическая) | Шестиугольный | Шестиугольный |
| Космическая группа | Т 2 д -F 4 3м | С 4 6v -P6 3 тс | С 4 6v -P6 3 тс |
| Символ Пирсона | cF8 | hP8 | HP12 |
| Константы решетки (Å) | 4,3596 | 3.0730; 10,053 | 3.0810; 15.12 |
| Плотность (г / см 3 ) | 3,21 | 3,21 | 3,21 |
| Ширина запрещенной зоны (эВ) | 2.36 | 3,23 | 3,05 |
| Объемный модуль (ГПа) | 250 | 220 | 220 |
| Теплопроводность (Вт⋅м −1 ⋅K −1 ) @ 300 K (см. Температурную зависимость) | 360 | 370 | 490 |
Чистый SiC бесцветен. Цвет промышленного продукта от коричневого до черного возникает из-за примесей железа . Радуги , как блеск кристаллов происходят из – за помехи тонкопленочных о наличии пассивирующего слоя из диоксида кремния , который образуется на поверхности.
Высокая температура сублимации SiC (около 2700 ° C) делает его полезным для подшипников и деталей печей. Карбид кремния не плавится ни при какой известной температуре. Он также очень инертен химически. В настоящее время существует большой интерес к его использованию в качестве полупроводникового материала в электронике, где его высокая теплопроводность, высокая пробивная напряженность электрического поля и высокая максимальная плотность тока делают его более перспективным, чем кремний, для устройств большой мощности. SiC также имеет очень низкий коэффициент теплового расширения (4,0 × 10 -6 / K) и не испытывает фазовых переходов, которые могли бы вызвать скачки в тепловом расширении.
Электрическая проводимость
Карбид кремния – это полупроводник , который может быть легирован азотом или фосфором n-типа и бериллием , бором , алюминием или галлием p-типа . Металлическая проводимость была достигнута за счет сильного легирования бором, алюминием или азотом.
Сверхпроводимость была обнаружена в 3C-SiC: Al, 3C-SiC: B и 6H-SiC: B при той же температуре 1,5 К. Однако наблюдается существенная разница в поведении магнитного поля между легированием алюминия и бором: SiC: Al это тип II , такой же, как Si: B. Напротив, SiC: B является тип-I . В попытке объяснить это различие было отмечено, что узлы Si более важны, чем узлы углерода для сверхпроводимости в SiC. В то время как бор замещает углерод в SiC, Al замещает позиции Si. Следовательно, Al и B «видят» разные среды, которые могут объяснить разные свойства SiC: Al и SiC: B.
Применение
Микроконтроллер 1993 года с УФ стиранием памяти 62E40 европейской фирмы STMicroelectronics. За окошечком виден кристалл микросхемы — кремниевая подложка с выполненной на ней схемой.
Технический кремний находит следующие применения:
- сырьё для металлургических производств: компонент сплава (бронзы, силумин); раскислитель (при выплавке чугуна и сталей); модификатор свойств металлов или легирующий элемент (например, добавка определённого количества кремния при производстве трансформаторных сталей уменьшает коэрцитивную силу готового продукта) и т. п.;
- сырьё для производства более чистого поликристаллического кремния и очищенного металлургического кремния (в литературе «umg-Si»);
- сырьё для производства кремнийорганических материалов, силанов;
- иногда кремний технической чистоты и его сплав с железом (ферросилиций) используется для производства водорода в полевых условиях;
- для производства солнечных батарей;
- антиблок (антиадгезивная добавка) в промышленности пластмасс.
Монокристалл кремния, выращенный по методу Чохральского
Сверхчистый кремний преимущественно используется для производства одиночных электронных приборов (нелинейные пассивные элементы электрических схем) и однокристальных микросхем. Чистый кремний, отходы сверхчистого кремния, очищенный металлургический кремний в виде кристаллического кремния являются основным сырьевым материалом для солнечной энергетики.
Монокристаллический кремний — помимо электроники и солнечной энергетики, используется для изготовления зеркал газовых лазеров.
Соединения металлов с кремнием — силициды — являются широко употребляемыми в промышленности (например, электронной и атомной) материалами с широким спектром полезных химических, электрических и ядерных свойств (устойчивость к окислению, нейтронам и др.). Силициды ряда элементов являются важными термоэлектрическими материалами.
Соединения кремния служат основой для производства стекла и цемента. Производством стекла и цемента занимается силикатная промышленность. Она также выпускает силикатную керамику — кирпич, фарфор, фаянс и изделия из них.
Широко известен силикатный клей, применяемый в строительстве как сиккатив, а в пиротехнике и в быту для склеивания бумаги.
Получили широкое распространение силиконовые масла и силиконы — материалы на основе кремнийорганических соединений.
Современность
В конце XX был изготовлен первый кристалл карборунда, до этого он был известен только в виде порошка. Как только появилась возможность синтезировать кристалл — его синтезировали. Результат оказался поразительным. По многим показателям карборунд превосходил алмаз.
- степень светопреломления на четверть выше;
- дисперсия — в два с половиной.

То есть он лучше блестит и даёт больше радужных бликов. Казалось бы — вот она, удача. Его действительно признали лучшей имитацией алмаза. Но в массовым он так и не стал. Делать ювелирные изделия с карборудном с точки зрения коммерции бессмысленно.
Производство украшений из камня слишком сложное и затратное дело. Крупный образец будет стоить порядка 500 долларов за карат. Сомнительно, что найдутся любители покупать искусственные камни за такие деньги. Даже если они высокотехнологичные и сверхблестящие. Сейчас кристаллы карбида кремния делает только одна американская компания, а в продаже он встречается реже, чем бриллиант.
Теоретически камень должен быть красивым: блестящий, сияющий, с радужной игрой света на гранях.
Но ценители камня его не очень ценят. На то есть несколько причин:
- яркие переливы света непривычны глазу и скорее раздражают, создают впечатление безвкусности и кичливости;
- прозрачных и чистых по цвету камней нет. Все они имеют пыльный зеленоватый оттенок. Химики пока с этим ничего поделать не могут;
- лучики света, которые отбрасывает бриллиант плотные, яркие, с насыщенными оттенка. Карборунд даёт более прозрачные и тёмные отблески.
Как видим, искусственному муассаниту не удалось превзойти алмаз и вытеснить его с ювелирных прилавков.

Непрозрачные недорогие образцы предприимчивые итальянцы продают как куски лавы Везувия.
Однако у карборунда есть ряд преимуществ:
- он не оставляет на себе жировых отпечатков. Если долго щупать бриллиант, он покроется жировой плёнкой и блестеть перестанет. Карборунд к этому невосприимчив. сколько его не трогай — он продолжит блестеть;
- поскольку карборунд выращен искусственно, он лишён дефектов. Его ограняют в идеальные, математически точно выверенные кристаллы. К тому же на материале можно не экономить. С бриллиантами это не всегда проходит. Иногда хочет сохранить вес камня и умышленно нарушает пропорции, иногда обходит дефекты. Браком это не считаются. Такие бриллианты хоть и стоят ниже, но на рынок поступают;
- в экстремальных температурах (около 1000 градусов Цельсия) алмаз горит, а карборунд нет. Вы можете кинуть платиновое кольцо в угольную печь и оно не пострадает.
Кроме этого он прочный, лишь незначительно уступает алмазу. К тому же он инертный — не вступает в реакцию с другими веществами (кроме плавиковой, азотной и ортофосфорной кислот), отличается высокой теплопроводностью, плотностью электрического тока и электрическим напряжением, имеет малый коэффициент теплового расширения и не имеет фазовых переходов, разрушающих кристалл.

Сейчас карборунд производят методом термического разложения полиметилсилана при низких температурах в присутствии инертного газа. Полученный материал применяется во многих сферах жизни.
Применяется в качестве:
- абразив для шлифования и напыление для пил;
- сырьё для режущих инструментов;
- полупроводник в электротехнической промышленности;
- катализатор в химической промышленности;
- подшипники и элементы оборудования в плавильных печах, поскольку он выдерживает нагрузку до 1700 градусов Цельсия;
- сырьё для производства бронежилетов;
- основа для сверхмощных светодиодов;
- сырьё для изготовления высококачественных дисковых тормозов;
- сырьё для создания зеркальных деталей в оптических системах.
Это далеко не всё. Камень используется в ядерной энергетике, строительстве, органическом синтезе.
Свойства
 Кремний (Silicium, силициум, Si — обозначение в химических соединениях и реакциях). Это не металл, хотя по внешним характеристикам (металлический блеск, цвет) его сложно отличить от настоящих металлов. Он относится к полуметаллам (металлоидам). По типу проводимости относится к полупроводникам.
Кремний (Silicium, силициум, Si — обозначение в химических соединениях и реакциях). Это не металл, хотя по внешним характеристикам (металлический блеск, цвет) его сложно отличить от настоящих металлов. Он относится к полуметаллам (металлоидам). По типу проводимости относится к полупроводникам.
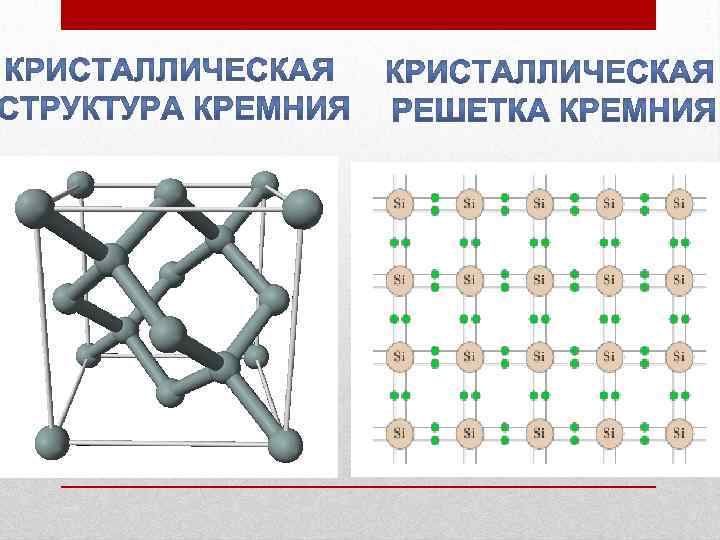
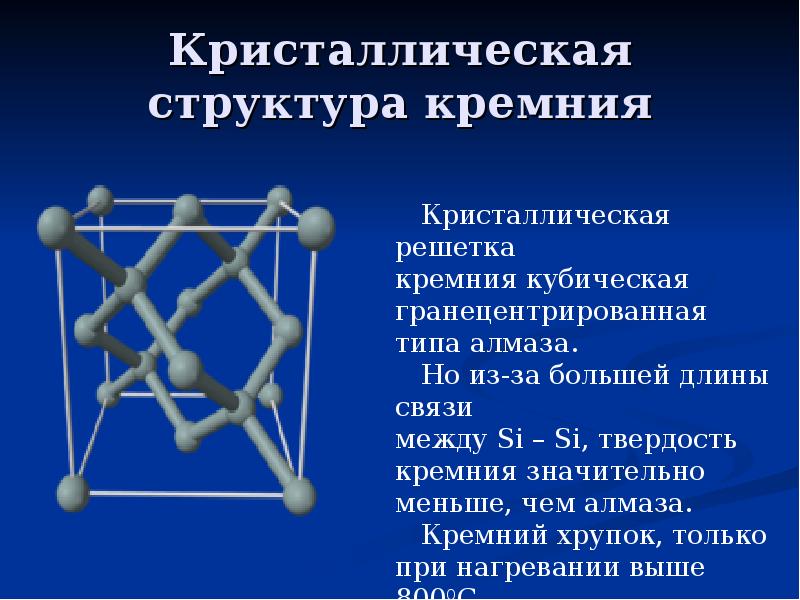
Существует в двух модификациях (видах): аморфной и кристаллической.
Классификация
| Strunz (8-ое издание) | 1/B.05-10 |
| Nickel-Strunz (10-ое издание) | 1.CB.15 |
| Dana (7-ое издание) | 1.3.6.1 |
| Dana (8-ое издание) | 1.3.7.1 |
| Hey’s CIM Ref. | 1.28 |
Физические свойства
| Цвет минерала | железно-черный, красновато-коричневый |
| Цвет черты | чёрный |
| Прозрачность | непрозрачный |
| Блеск | металлический |
| Спайность | отсутствует |
| Твердость (шкала Мооса) | 7 |
| Излом | раковистый |
| Плотность (измеренная) | 2.09 — 2.23 г/см3 |
| Радиоактивность (GRapi) |
Химические свойства Кремния
Тут много конечно можно сказать, но остановлюсь на самом интересном. В соединениях Si (аналогично углероду) 4-валентен. На воздухе кремний благодаря образованию защитной оксидной пленки устойчив даже при повышенных температурах. В кислороде окисляется начиная с 400 °С, образуя оксид кремния (IV) SiO2.
Кремний устойчив к кислотам и растворяется только в смеси азотной и фтористоводородной кислот, легко растворяется в горячих растворах щелочей с выделением водорода.
Кремний образует 2 группы кислородсодержащих силанов — силоксаны и силоксены
С азотом Кремний реагирует при температуре выше 1000 °С, Важное практическое значение имеет нитрид Si3N4, не окисляющийся на воздухе даже при 1200 °С, стойкий по отношению к кислотам (кроме азотной) и щелочам, а также к расплавленным металлам и шлакам, что делает его ценным материалом для химической промышленности, а так же для производства огнеупоров. Высокой твердостью, а также термической и химической стойкостью отличаются соединения Кремния с углеродом (карбид кремния SiC) и с бором (SiB3, SiB6, SiB12)
Оптические свойства
| Тип | изотропный |
| Показатели преломления | nω = 3.4223 |
| Анизотропия | нет |
| Плеохроизм | нет |
| Люминесценция в ультрафиолетовом излучении | не флюоресцентный |
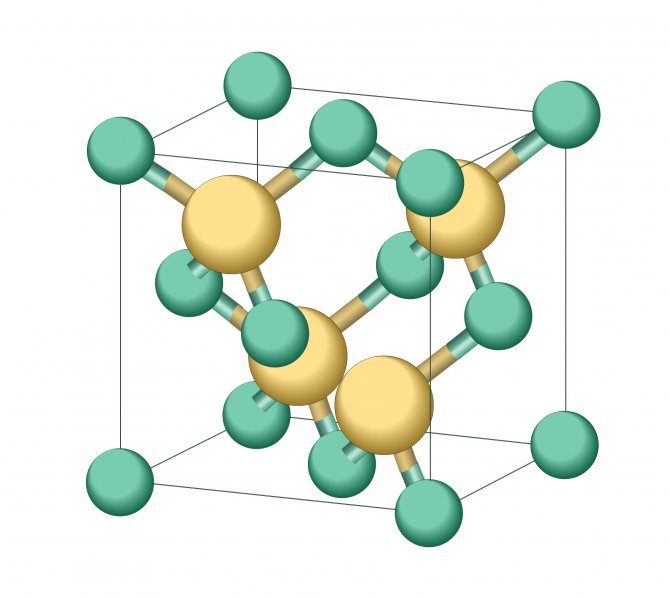
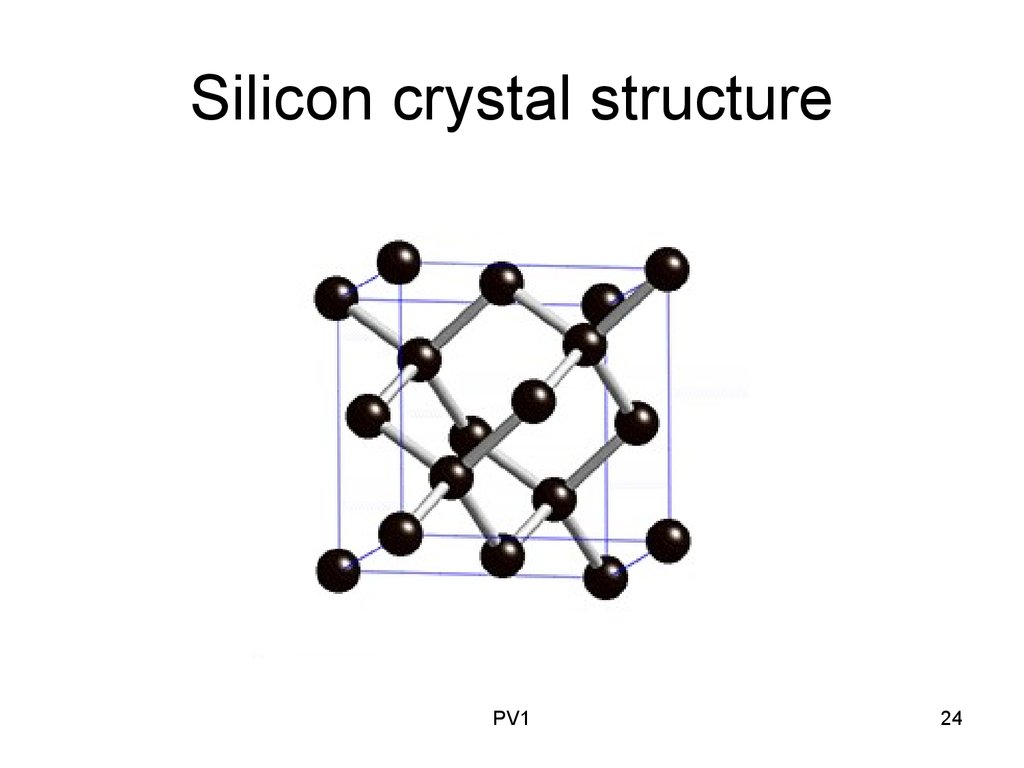
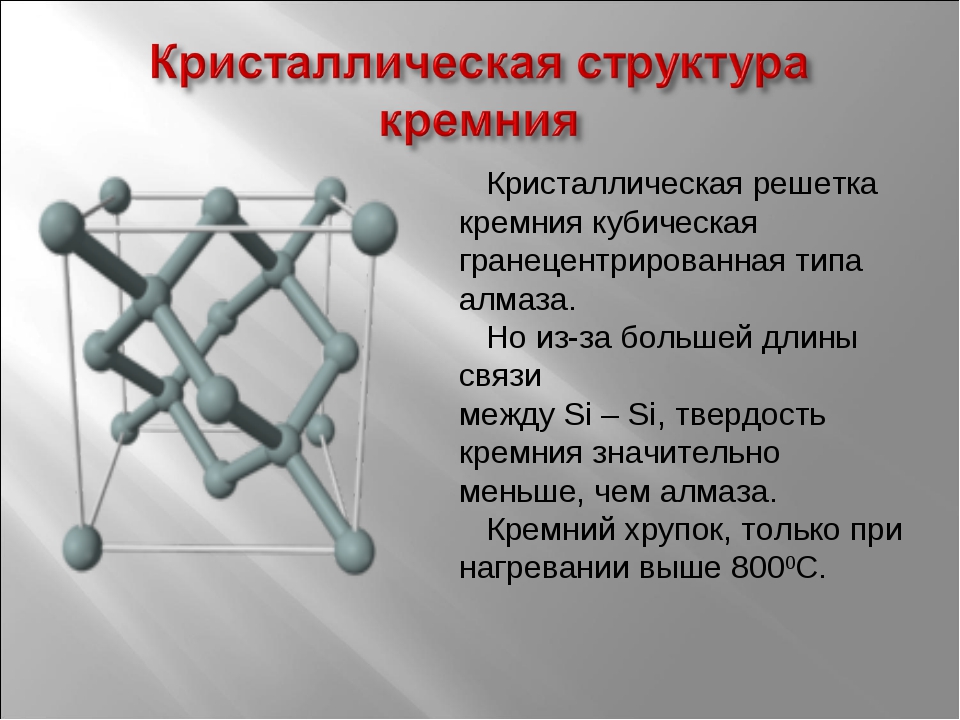
Кристаллография
| Точечная группа | (4/m 3 2/m) — изометрическая-гексаоктаэдральная |
| Пространственная группа | F d3m |
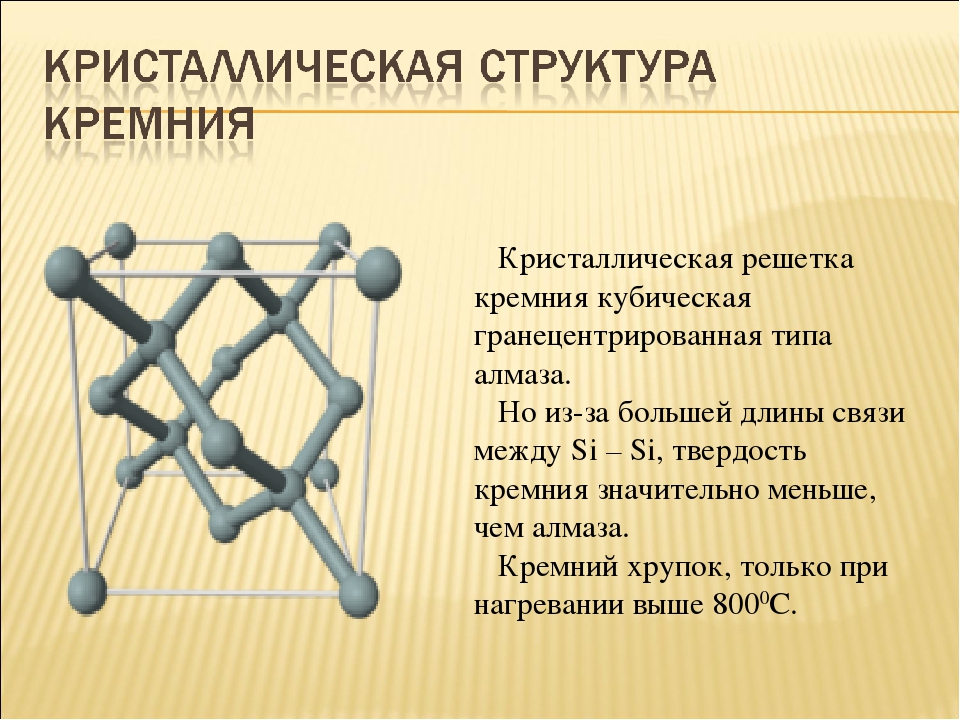
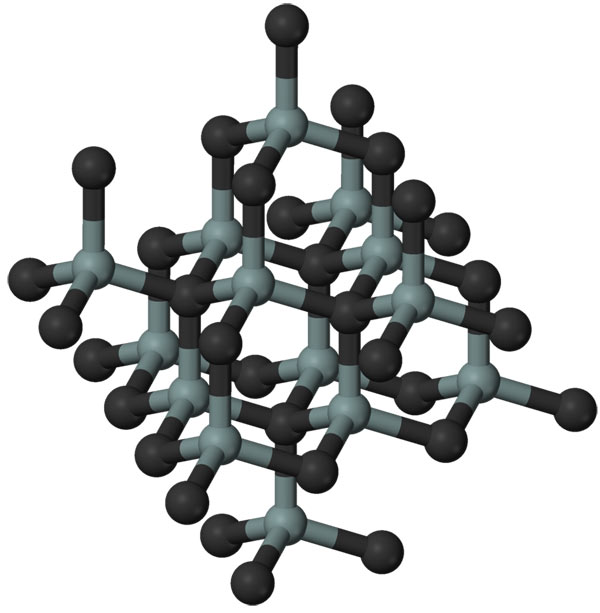
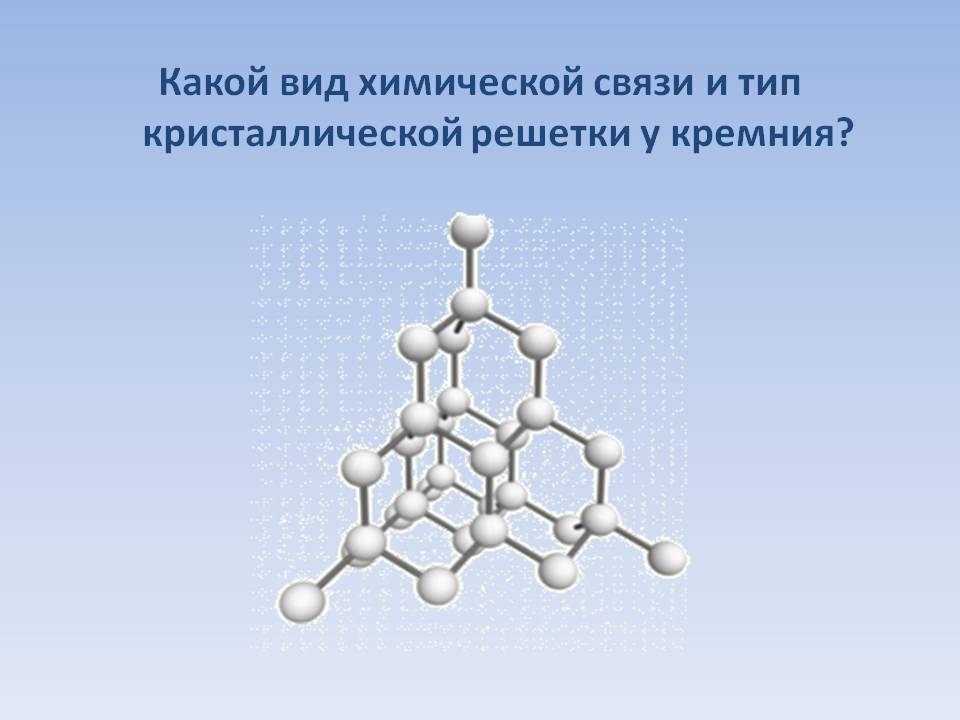
| Сингония | кубическая |
| Параметры ячейки | a = 5.431 |
| Двойникование | нет |
Электронное строение кремния
Электронная конфигурация кремния восновном состоянии:
+14Si 1s22s22p63s23p2 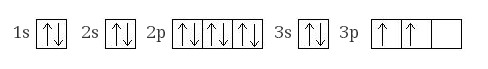
Электронная конфигурация кремния ввозбужденном состоянии:
+14Si* 1s22s22p63s13p3 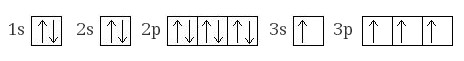
Атом кремния содержит на внешнем энергетическом уровне 2 неспаренных электрона и 1 неподеленную электронную пару в основном энергетическом состоянии и 4 неспаренных электрона в возбужденном энергетическом состоянии.
Степени окисления атома кремния — от -4 до +4. Характерные степени окисления -4, 0, +2, +4.
Нахождение в природе кремния
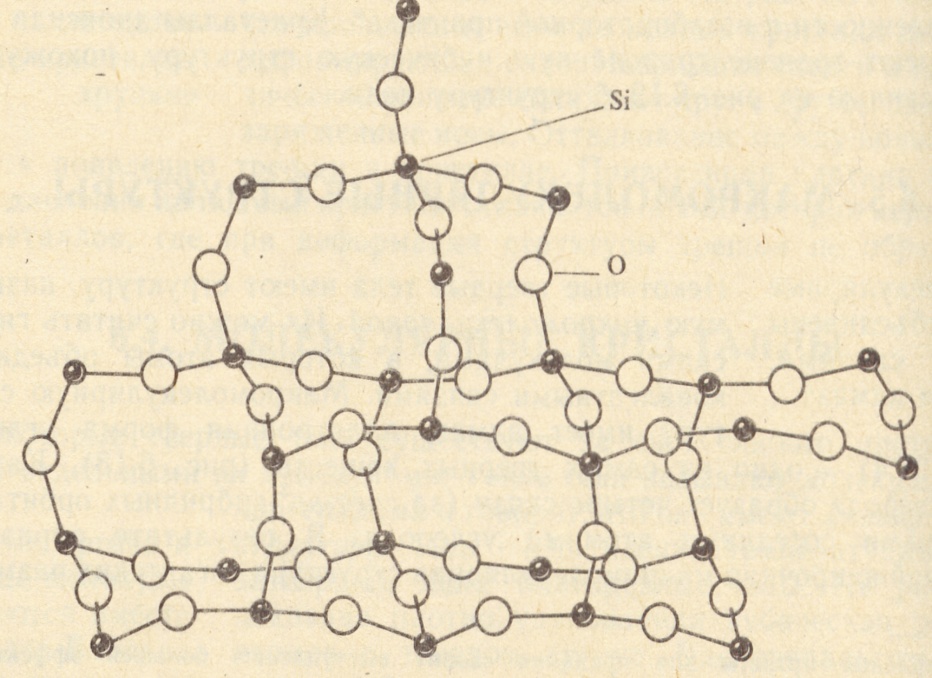
Кремний — второй по распространенности элемент на Земле после кислорода. Встречается только в виде соединений. Оксид кремния SiO2 образует большое количество природных веществ – горный хрусталь, кварц, кремнезем.

Простое вещество кремний – атомный кристалл темно-серого цвета с металлическим блеском, довольно хрупок. Температура плавления 1415 °C, плотность 2,33 г/см3. Полупроводник.
Сфера применения
Древесный уголь используется в промышленности в следующих целях:
- для применения в составе фильтров;
- для плавки кристаллического кремния;
- для использования в металлургии (насыщение стали углеродом, получение чистых сплавов);
- для производства стекла, некоторых видов пластмасс, красок;
- для изготовления натурального красителя для пищевой промышленности;
- для изготовления активированного угля;
- для использования в сельском хозяйстве;
- для применения в качестве удобного бытового топлива для печей, каминов, мангалов.
При сжигании в печах и каминах данный вид топлива сгорает практически без языков пламени, обеспечивая ровный и интенсивный жар. Наиболее высоко ценится продукт марки А, который изготавливается из твердых пород древесины.
Муассанит (карборунд)
Последней попыткой создания качественной синтетической имитации бриллианта оказались муассаниты
Говоря о муассаните, очень важно понимать разницу между природным минеральным образованием и его одноименным синтетическим аналогом
Минерал муассанит является природным, назван в честь его первооткрывателя, Анри Муассана (1852-1907), Нобелевского лауреата по химии (1906 год). Природный муассанит не пригоден для огранки в драгоценные камни из-за очень мелкого (максимум 2-3мм) размера зерен, темного непрозрачного света и исключительной редкости. Муассанит представляет из себя карбид кремния SiC, с гексагональной кристаллической структурой ( в отличие от кубической у алмаза)
Муассанит был синтезирован еще до того (1893), как был обнаружен (1905) в природе.
В 1987 году в лаборатории Cree Research (США) был найден способ синтеза бесцветного муассанита. Правда, до 1993 года эти камни не были совсем бесцветными, если выразиться точнее – они были в лучшем случае околобесцветными и соответствовали цвету не выше (у лучших образцов) I-J по шкале GIA для бриллиантов. В 1998 году была запатентована технология синтеза реально бесцветных муассанитов методом сублимации, и с тех пор эти камни имеют зарегистрированное торговое название “Charles & Colvard created Moissanite”
С момента появления на рынке в 1976 году CZ (фианитов в российском варианте) муассанит оказался наилучшим из известным симулянтов бриллианта. Однако натренированный глаз может легко отличить муассанит от “лучшего друга девушки”.
Из-за отличной от алмаза кристаллической структуры муассонит обладает очень сильным двупреломлением, которое в принципе невозможно для алмаза (бриллианта)
Из-за отличной от алмаза кристаллической структуры муассонит обладает очень сильным двупреломлением, которое в принципе невозможно для алмаза (бриллианта). Если посмотреть “сквозь” муассанит по углом к его верхней площадке, то ВСЕГДА будет хорошо заметно раздвоение граней павильона. То есть как бы грани будут выглядеть как на “размытой нерезкой фотографии”.
Надежным идентификатором муассанита является его относительная плотность (3.22 против 3.52 у бриллианта). В метилен иодиде более плотный бриллиант утонет, а менее плотный муассанит будет “плавать”.
“Точечный тест” не поможет из-за очень высокого коэффициента преломления у муассанита – не покажет отличие муассонита от бриллианта, но покажет отличие от природного или синтетического циркона.
Надежным способом гарантированной идентификации муассанитов является их нагрев до температуры свыше 230 градусов. При этой температуре все без исключения муассаниты окрашиваются в зеленовато-желтый или коричневый цвет, который пропадает немедленно после остывания.
Нахождение в природе
Содержание кремния в земной коре составляет по разным данным 27,6—29,5 % по массе. Таким образом, по распространённости в земной коре кремний занимает второе место после кислорода. Концентрация в морской воде 3 мг/л.
Чаще всего в природе кремний встречается в виде кремнезёма — соединений на основе диоксида кремния (IV) SiO2 (около 12 % массы земной коры). Основные минералы и горные породы, образуемые диоксидом кремния, — это песок (речной и кварцевый), кварц и кварциты, кремень, полевые шпаты. Вторую по распространённости в природе группу соединений кремния составляют силикаты и алюмосиликаты.
Отмечены единичные факты нахождения чистого кремния в самородном виде.
Заключение
Подведем итоги. Карбиды металлов — соединения, в состав которых входит углерод и какой-либо дополнительный металл. Это может быть железо, хром, цирконий, вольфрам и другие. Соединение может образовывать сложную прочную кристаллическую решетку (ковалентную, металлическую, ионную). Карбиды из-за особенностей своего строения отличаются высокой прочностью, устойчивостью к механической деформации, химической инертностью. Вещества обычно не вступают в реакцию с кислотами, щелочами, солями, атмосферными газами (кислород, азот, углекислый газ).
Из карбидов делают абразивные или шлифовальные инструменты, поскольку они не деформируются, не портятся со временем, могут деформировать другие прочные соединения. Из них делают электроды для сварочных инструментов, термоустойчивые стержни, элементы электрических инструментов. Некоторые виды карбидов могут проявлять необычные свойства. Скажем, карбид золота взрывается при легком контакте, а карбид кальция может вступать в реакцию с водой при комнатной температуре с образованием ацетилена.
- Статья на Википедии
- Самсонов Г. В., Косолапова Т. Я., Домасевич Л. Т. Свойства, методы получения и области применения тугоплавких карбидов и сплавов на их основе. Киев, 1974
- Gusev A. I., Rempel A. A. Nanocrystalline Materials. — Cambridge: Cambridge International Science Publishing, 2004.
- Вальков Ф. А. Неорганическая химия, учебник для педагогических вузов. — М.: Государственное учебно-педагогическое издательство, 1963.