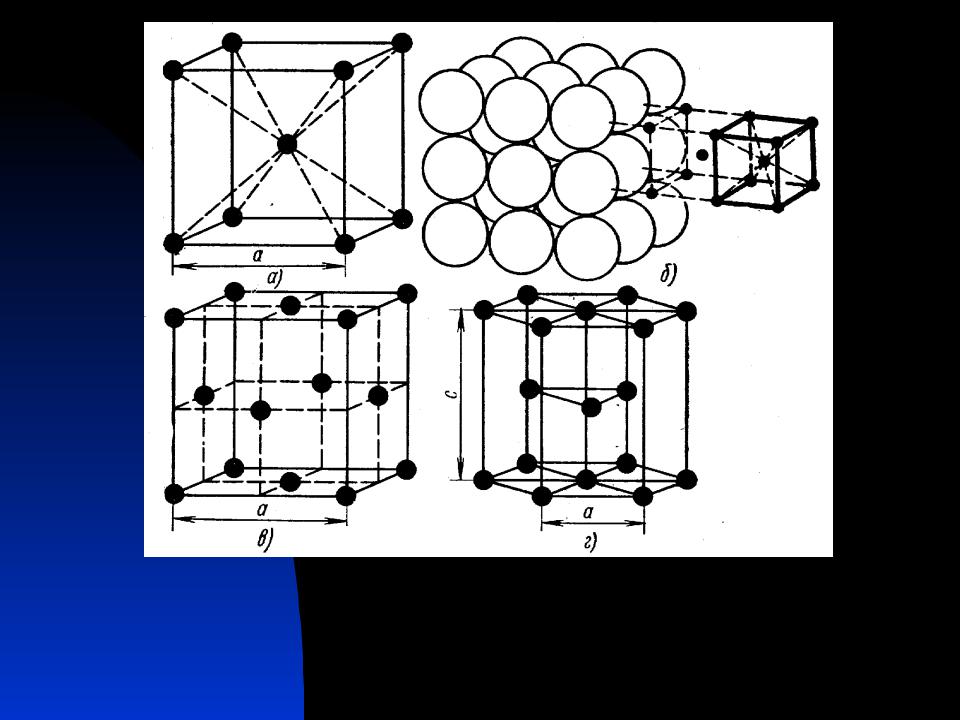
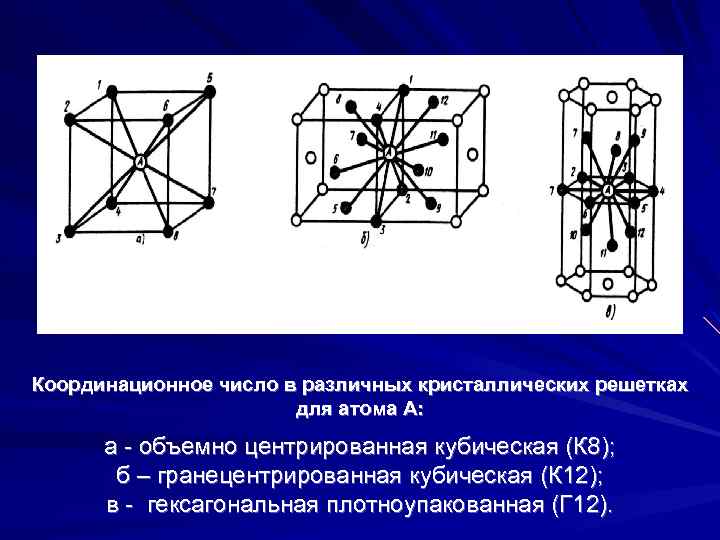
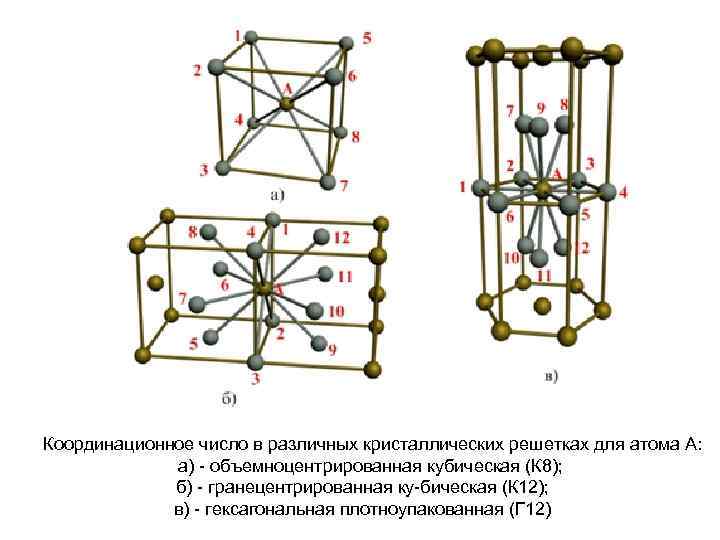
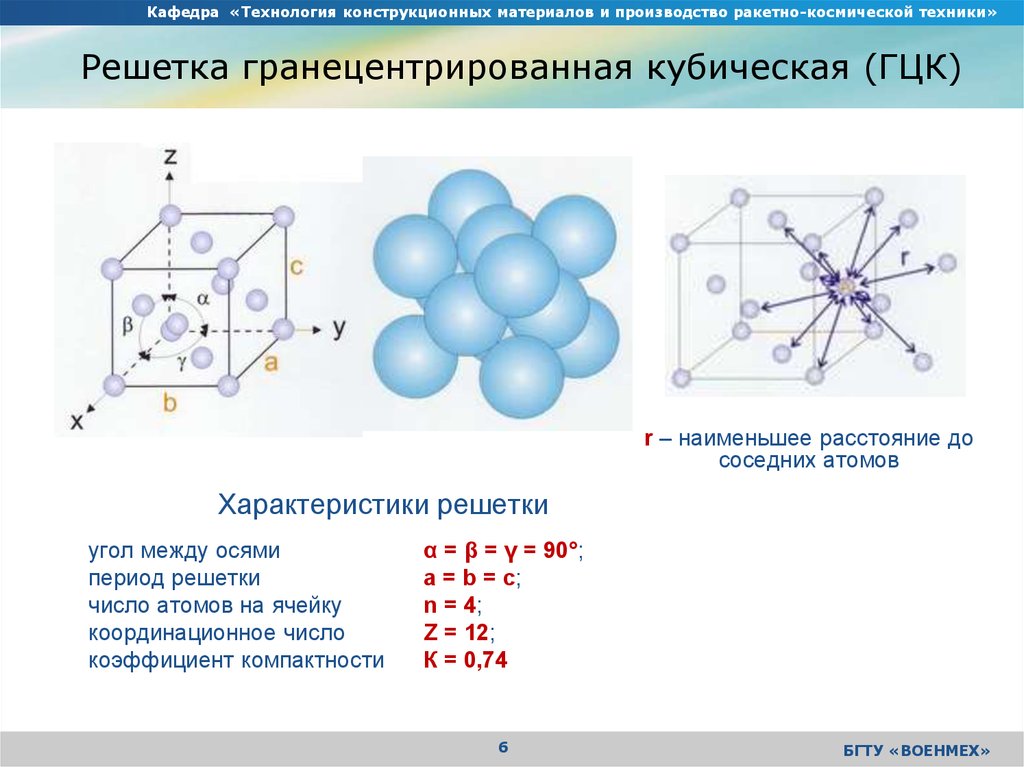
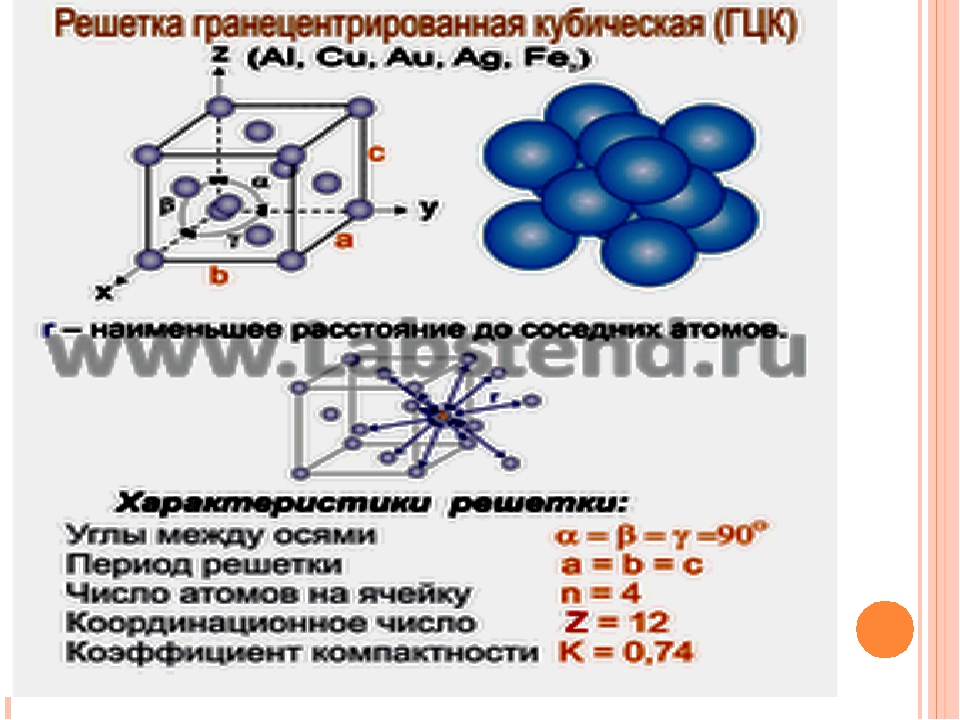
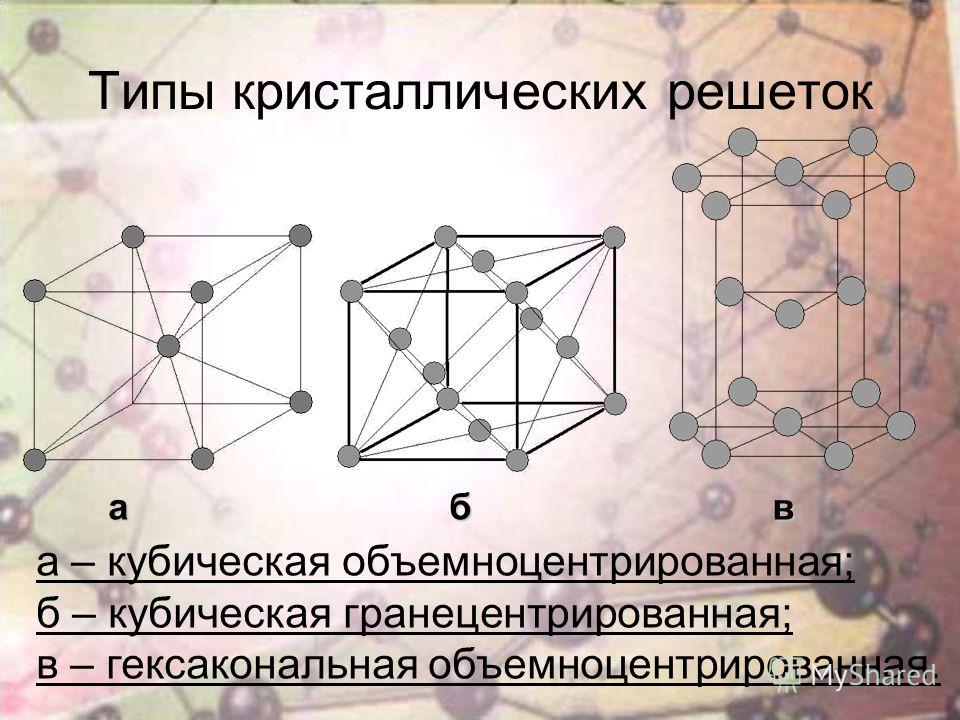
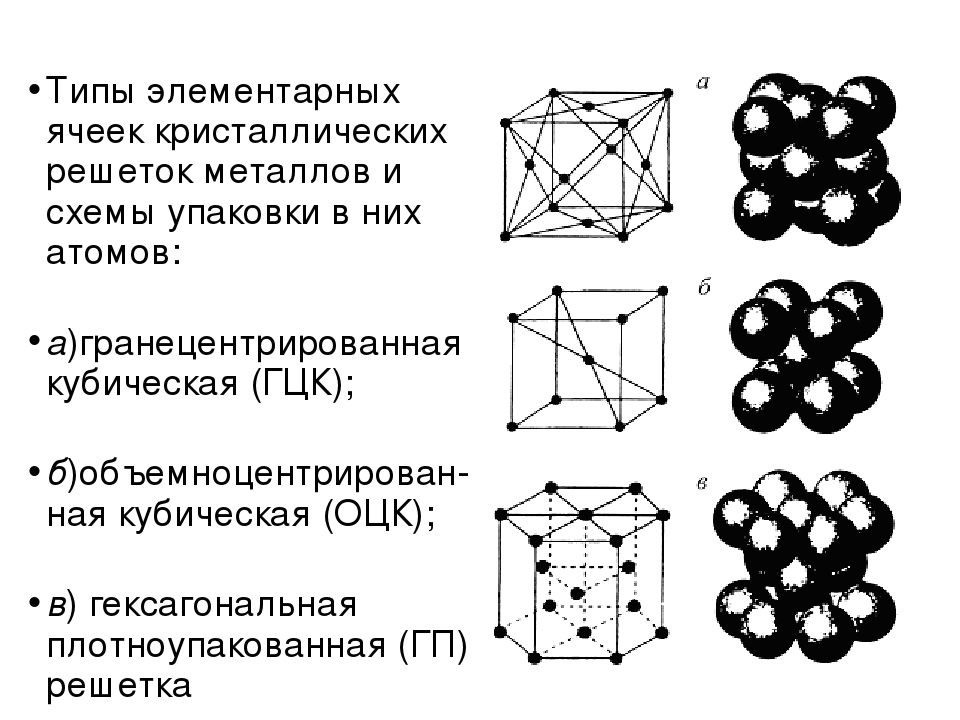
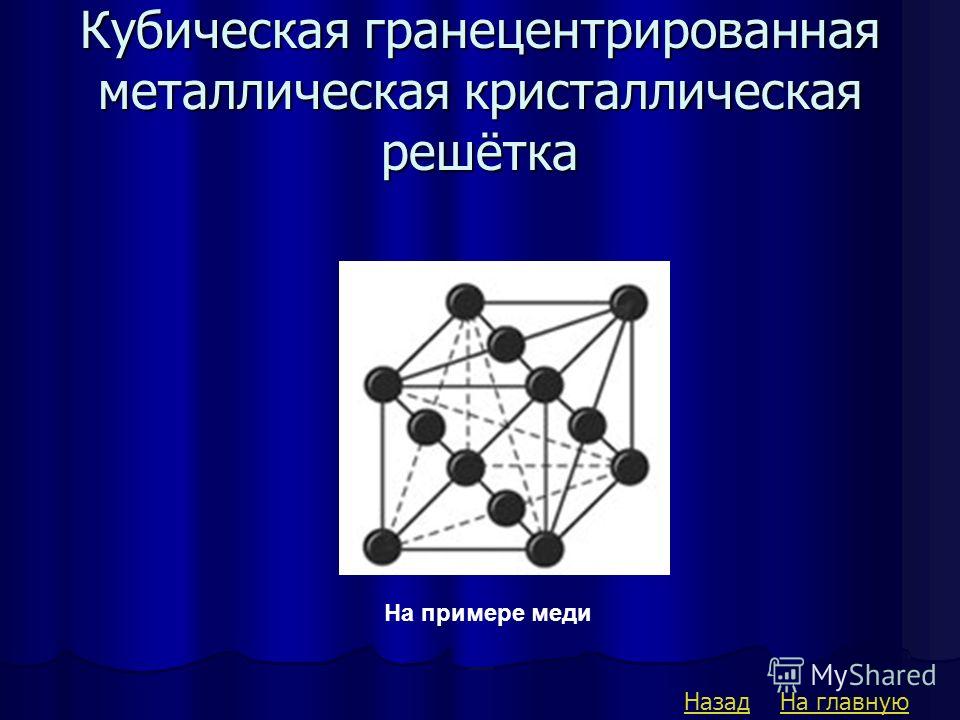
Кубическая гранецентрированная решетка
Алюминий является трехвалентным растворителем и имеет кубическую гранецентрированную решетку. Первая зона Брил-люэна у алюминия может вместить только два электрона на атом, и поэтому она должна перекрываться поверхностью Ферми. Однако, как показал Харрисон , степень перекрытия может быть различной, если исходить из сферической формы поверхности Ферми, характерной для свободных электронов. Наличие такого перекрытия у чистого алюминия, очевидно, весьма незначительно отражается на периоде решетки при образовании сплавов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов.
Медь и золото, кристаллизующиеся в кубической гранецентрированной решетке, образуют между собой при повышенных температурах и закалке непрерывный ряд твердых растворов. При отжиге происходит процесс упорядочения в распределении атомов золота и меди в кристаллической структуре, причем степень упорядочения будет наибольшей для атомных соотношений Си: Аи 3: 1 и Си: Аи 1: 1, отвечающих соединениям Cu3Au и CuAu. Поскольку каждый атом в вершине куба принадлежит одновременно восьми соседним ячейкам, на данную ячейку приходится / 8 атома ill.
Рассмотрим увеличение концентрации свободных электронов в кубической гранецентрированной решетке ограниченного а-твердого раствора при добавлении элемента с более высоким номером группы периодической системы по сравнению с растворителем.
| Гексагональная плотнейшая упаковка. Пример. Mg ( a 3 22. с 5 23 А. |
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Стронций, подобно кальцию, кристаллизуется в кубической гранецентрированной решетке, а – 6 05 А.
Ковкость уменьшается при переходе от кристаллов с кубической гранецентрированной решеткой к металлам с центрированной кубической и гексагональной решетками. Условия, определяющие образование или изменение кристаллической структуры, сильно влияют на ковкость металлов или сплавов. До определенной температуры ковкость растет за счет ослабления связи между кристалликами, а после достижения допустимой максимальной температуры ковкость уменьшается – металлы становятся хрупкими. Это связано с образованием окисных пленок между кристаллами.
Эта формула строго справедлива для кристаллов с кубической гранецентрированной решеткой, однако при применении ее для кристаллов с другими типами решеток погрешность незначительна. Следует учитывать, что такого типа расчеты применимы для монокристаллов. Обычно же имеют дело с поликристаллическими сростками.
В гальванических сплавах Си-Sn наряду с кубической гранецентрированной решеткой меди и тетрагональной решеткой олова обнаружены еще две промежуточные фазы. Рассмотрим более подробно несколько систем.
Структура фтористого кальция показана на рис. 10.4. Это кубическая гранецентрированная решетка.
СМ) 6 атомы железа расположены в узлах кубической гранецентрированной решетки. На рис. 22.5 атомы Fe ( II) представлены заштрихованными кружками, а атомы Fe ( III) – светлыми. На рис. а все атомы железа находятся в трехвалентном состоянии; на рис. б половина атомов – это Fe ( II), а другая половина – Fe ( III); атомы щелочных металлов обеспечивают электронейтралыюсть соединения. Они расположены в центрах чередующихся малых кубов; предполагается, что в гидратированпых соединениях молекулы воды также могут располагаться в пустотах основной сетки. Литий и цезий, представляющие собой соответственно очень малый и очень большой ионы, не дают соединений, имеющих такую структуру. На рис. в все атомы железа находятся в двухвалентном состоянии, и внутри каждого малого куба находится атом щелочного металла. Группы CN располагаются между атомами металла вдоль сплошных линий на рис. 22.5, так что каждый атом переходного металла находится в центре октаэдра из 6 атомов С или 6 атомов N. Таким образом, в целом комплекс состава M / M ( CN) 6 образует простую 6-связанную трехмерную сетку.
| Первая зона ник называется первой зоной Бриллюэна Бриллюэна, симметрич -, х.. |
На рис. 2.6 показана первая зона Бриллюэна для кубической гранецентрированной решетки.
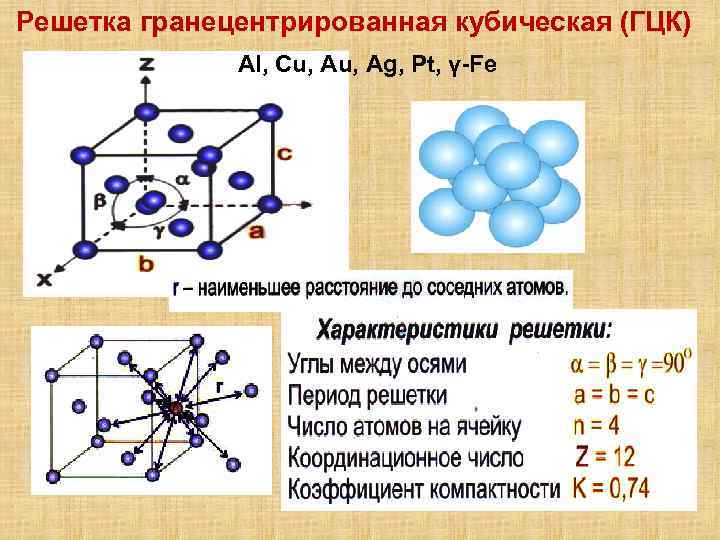
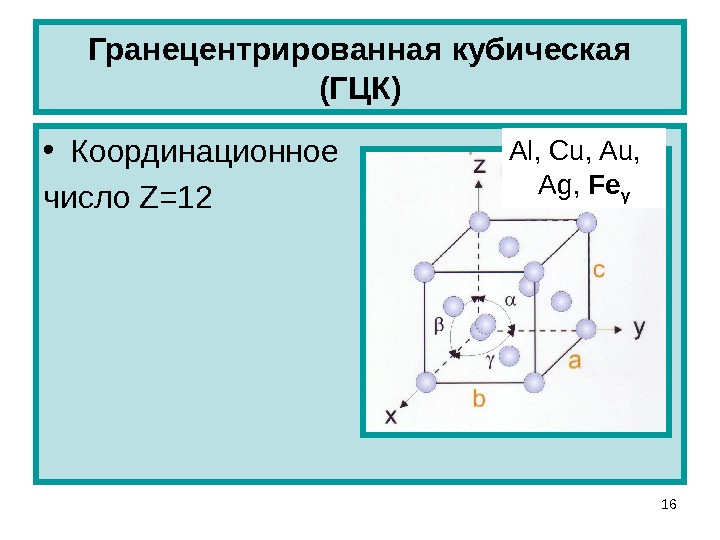
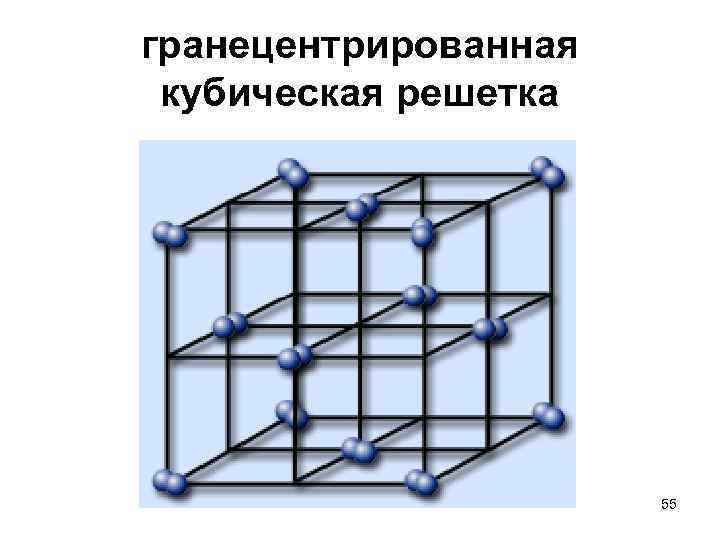
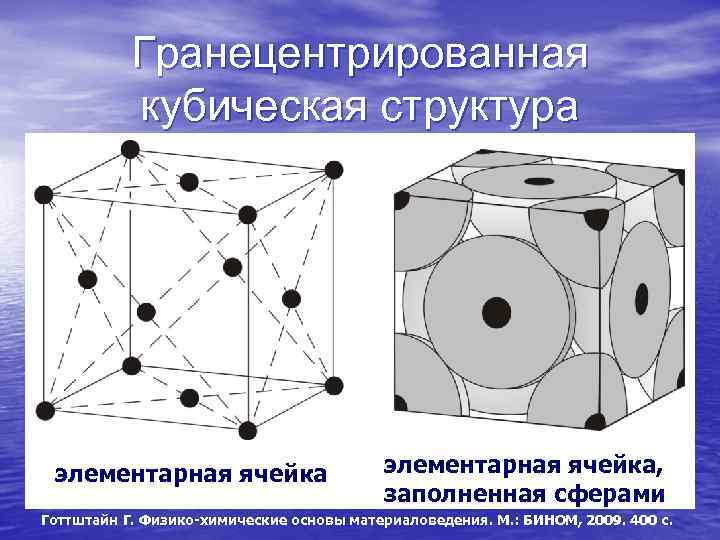
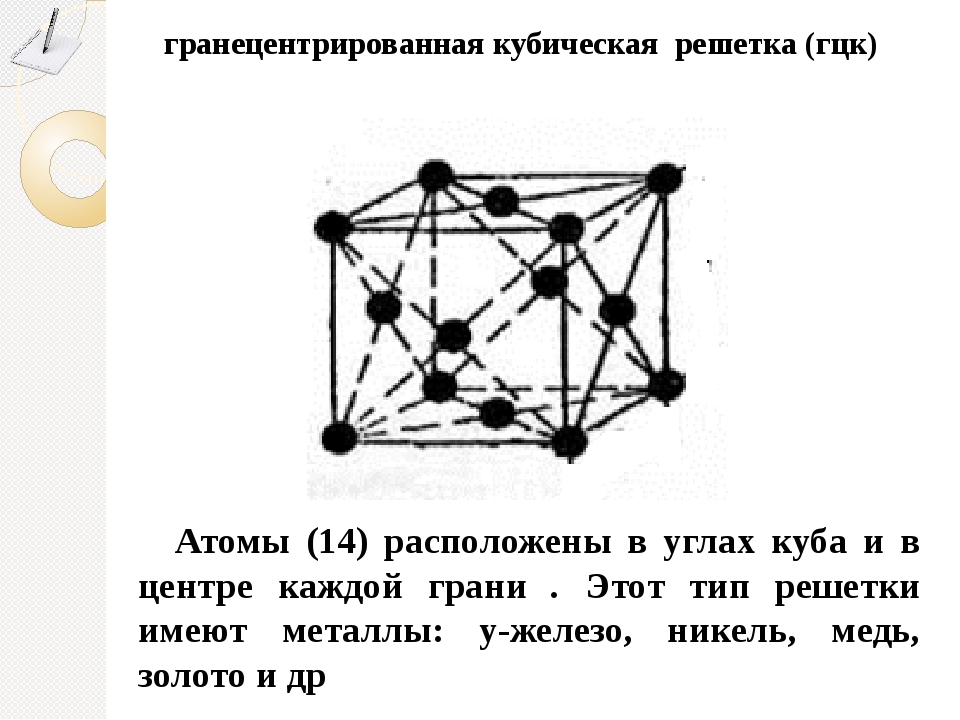
Гранецентрированная кубическая решетка
Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводностью и теплопроводностью, исключительно пластичен.
Кристаллизуется в гранецентрированной кубической решетке. Обладает высокой электрической проводимостью и теплопроводностью, исключительно пластичен.
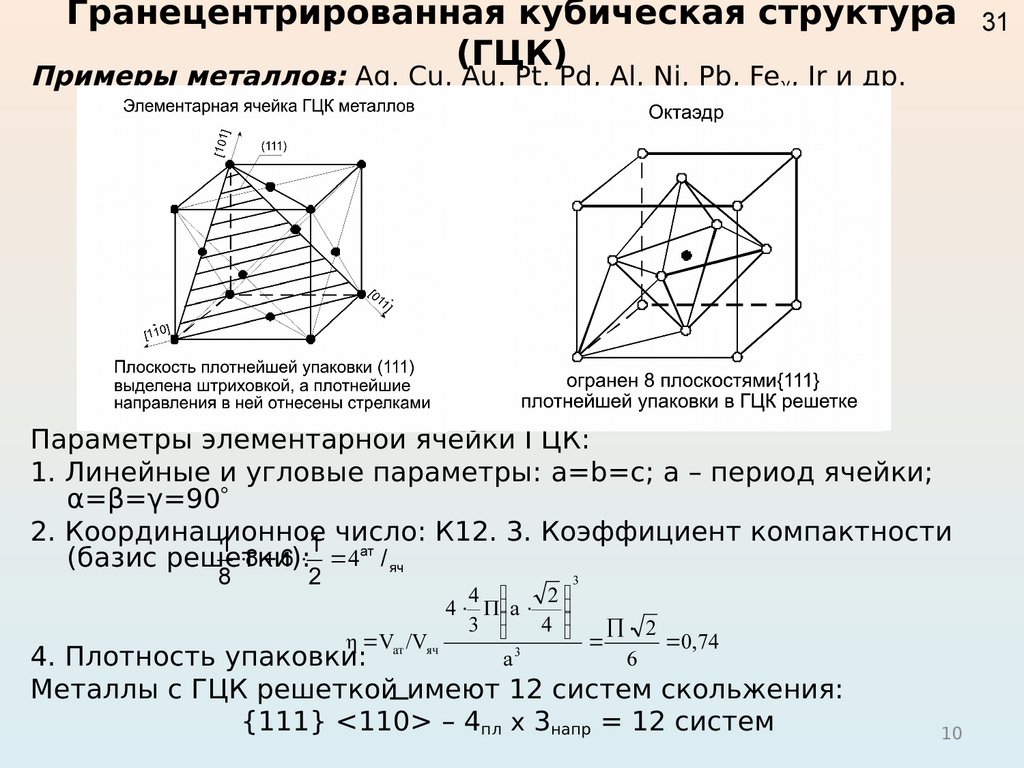
Например, гранецентрированной кубической решетке принадлежат только четыре атома, а не 14, как может показаться на первый взгляд.
Металлы с гранецентрированной кубической решеткой ( медь, никель, алюминий, аустенитные стали с высоким содержанием никеля) сохраняют свою пластичность при температуре жидкого кислорода. Металлы с объемно центрированной решеткой ( углеродистые стали, магний, вольфрам и др.) становятся в этих условиях хрупкими.
Металлы с гранецентрированной кубической решеткой ( медь, алюминий, никель, свинец, – железо, аустенитные стали) с понижением температуры сохраняют пластичность, у них увеличиваются пределы текучести и прочности, повышается твердость и уменьшается ударная вязкость. Металлы с объемноцентрированной кубической решеткой ( а-железо, вольфрам, магний, цинк, феррит-ные стали, чугун и др.) при низких температурах становятся хрупкими.
Металлы с гранецентрированной кубической решеткой ( медь, никель, алюминий, аустенитные стали с высоким содержанием никеля) сохраняют свою пластичность при температуре жидкого кислорода. Металлы с объемно-центрированной решеткой ( углеродистые стали, магний, вольфрам и др.) становятся в этих условиях хрупкими.
Медь обладает гранецентрированной кубической решеткой. Это металл красного ( в изломе розового) цвета, ковкий и мягкий; плотность 8960 кг / м3, / пл 1083 С. Химически она малоактивна; в атмосфере, содержащей СО2, пары Н2О и др., покрывается патиной.
| Кристаллические решетки металлов. а – объемно-центрированная ( ОЦК. б – гранецентрированная ( ГЦК. в – гексагональная ( ГПУ. – ребро куба. – диагональ грани куба. – диагональ куба. – ось симметрии призмы. |
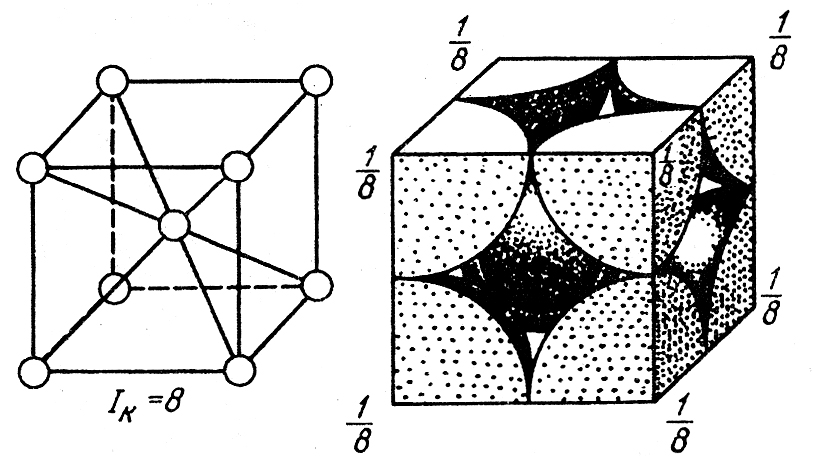
На элементарную ячейку гранецентрированной кубической решетки приходится четыре атома; из них один ( по такому же расчету, как и для объемно центрированной решетки) вносят атомы в вершинах куба, а три суммарно ( 1 / 2×6 3) вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
Если в узлах гранецентрированной кубической решетки поместить шары, то какая доля пространства будет заполнена шарами в случае плотной упаковки. Эта доля называется коэффициентом упаковки.
| Кристаллические решетки металлов. а – объемно-центрированная ( ОЦК. б – гранецешрированная ( ГЦК. в – гексагональная ( ПТУ. – ребро куба. – диагональ грани куба. – диагональ куба. – ось симметрии призмы. |
На элементарную ячейку гранецентрированной кубической решетки приходится четыре атома; из них один ( по такому же расчету, как и для объемно центрированной решетки) вносят атомы в вершинах куба, а три суммарно ( 1 / 2×6 3) вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
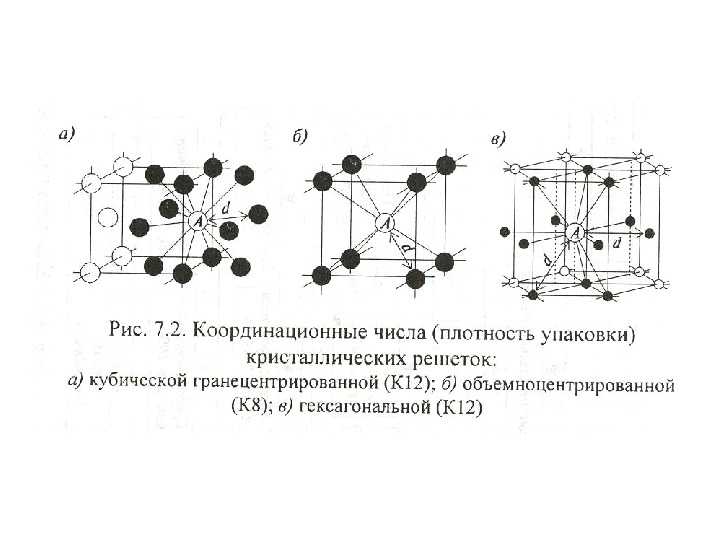
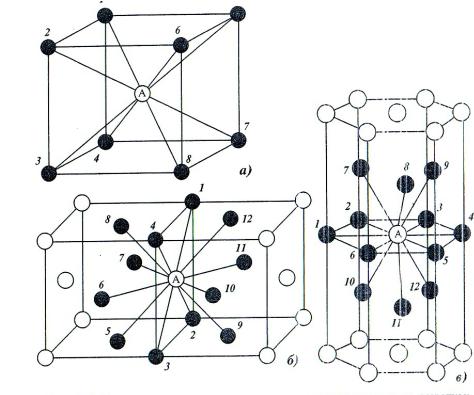
| Схема, показывающая число атомов, находящихся на равном и наименьшем расстоянии от данного атома ( А в различных кристаллических решетках. а – К12. 6 – К8. в – П2 ( С. С. Штейберг. |
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома; из них один атом ( по такому же расчету, как и для объемноцентрированной решетки) вносят атомы, находящиеся в вершинах куба ( YsXS), и три атома вносят атомы, находящиеся на середине грани, так как каждый из таких атомов принадлежит двум решеткам.
На элементарную ячейку гранецентрированной кубической решетки приходятся четыре атома: из них один образуется за счет атомов в вершинах куба, а три – суммарная ( 1 / 2 – 6 3) доля атомов, находящихся в серединах граней, так как каждый из этих атомов принадлежит двум ячейкам.
Атомная кристаллическая решетка
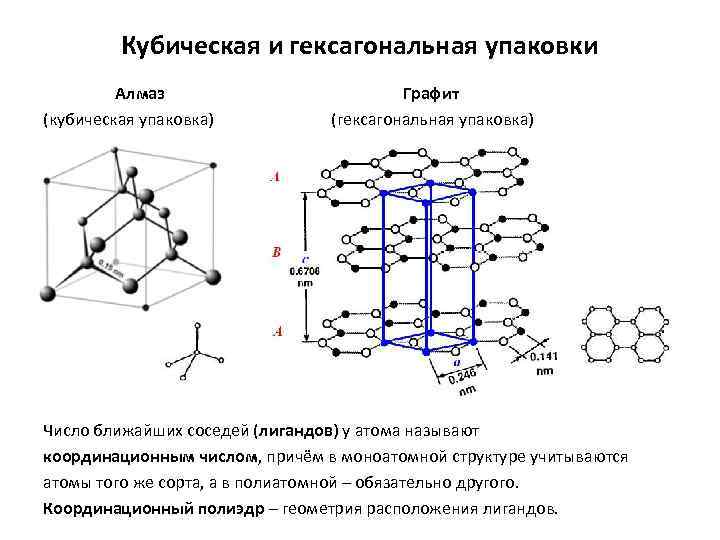
Вещества с атомной кристаллической решеткой, как правило, имеют в своих узлах, состоящих собственно из атомов сильные ковалентные связи. Ковалентная связь происходит, когда два одинаковых атома делятся друг с другом по-братски электронами, образуя, таким образом, общую пару электронов для соседних атомов. Из-за этого ковалентные связи сильно и равномерно связывают атомы в строгом порядке – пожалуй, это самая характерная черта строения атомной кристаллической решетки. Химические элементы с подобными связями могут похвастаться своей твердостью, высокой температурой плавления. Атомную кристаллическую решетку имеют такие химические элементы как алмаз, кремний, германий, бор.
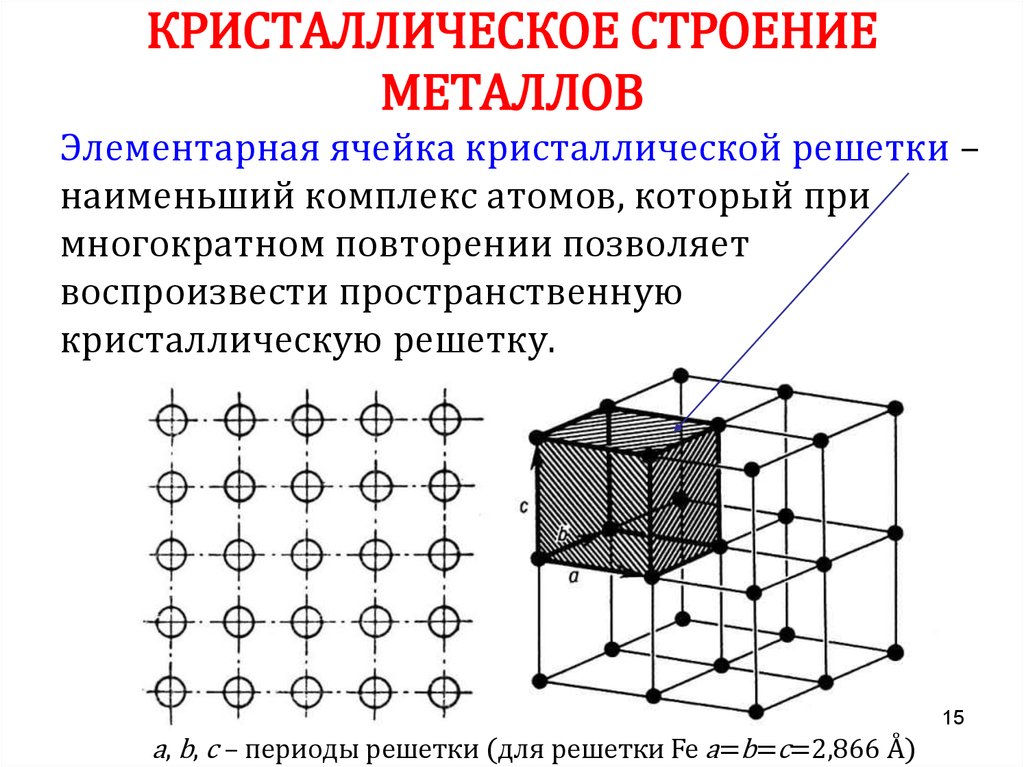
Определение кристаллической решетки
Как мы знаем, все материальные вещества могут пребывать в трех базовых состояниях: жидком, твердом, и газообразном. Правда есть еще состояние плазмы, которое ученые считают ни много ни мало четвертым состоянием вещества, но наша статья не о плазме. Твердое состояние вещества потому твердое, так как имеет особую кристаллическую структуру, частицы которой находятся в определенном и четко заданном порядке, создавая, таким образом, кристаллическую решетку. Строение кристаллической решетки состоит из повторяющихся одинаковых элементарных ячеек: атомов, молекул, ионов, других элементарных частиц, связанных между собой различными узлами.
Кристаллографическое использование[править | править код]
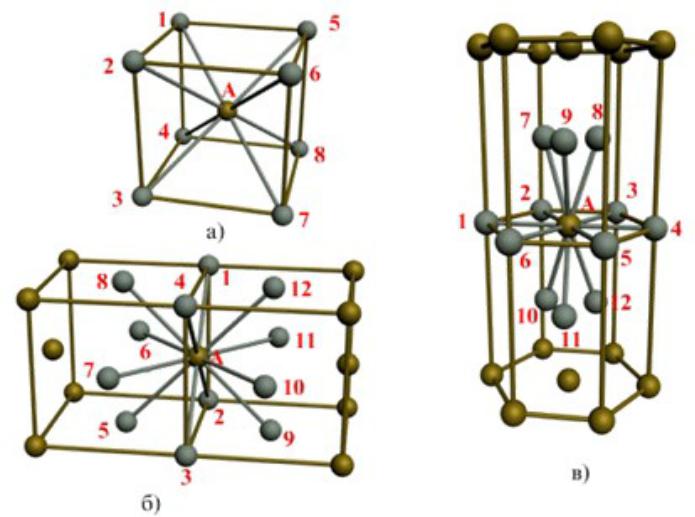
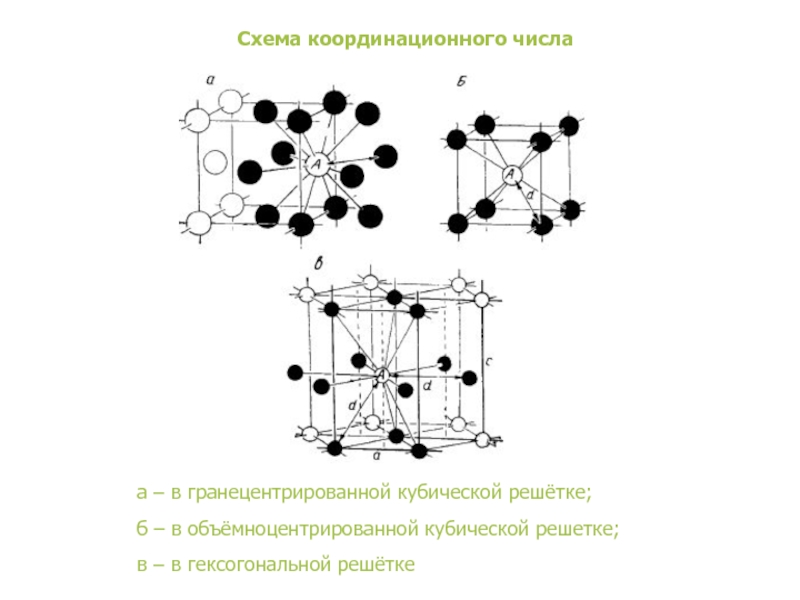
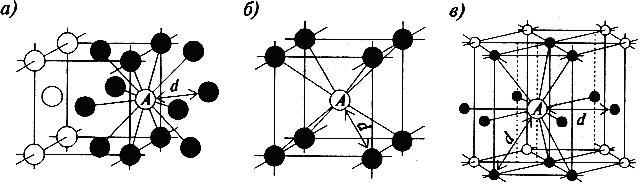
В кристаллической структуре геометрическая модель атома является геометрической структурой координации атомов, где определение координации атомов зависит от связей в модели. Например, в каменной соли, ионный состав каждого атома натрия содержит шесть ближайших соседних хлорид-ионов в октаэдрической геометрии и каждый хлорид аналогично — шесть соседних ионов натрия в октаэдрической геометрии. В металлах с объемноцентрированной структурой каждый атом имеет связь с восмью ближайшими другими атомами с кубической геометрией. В металлах с гранецентрированной кубической структурой каждый атом имеет двенадцать связей с соседними атомами с кубооктаэдрической геометрией.
| Координационное число | Геометрия | Изображение | Примеры дискретных (конечных) комплексов | Примеры на кристаллах |
|---|---|---|---|---|
| 2 | линейная | Ag(CN)2− в KAg(CN)2 | Ag в цианиде серебра,Au в AuI | |
| 3 | плоский треугольник | Cu(CN)32− в Na2Cu(CN)3·3H2O | O в TiO2 (структура рутила) | |
| 4 | тетраэдр | CoCl42− | Zn и S в сульфиде цинка, Si в диоксиде кремния | |
| 4 | квадрат | AgF4− | CuO | |
| 5 | тригональная бипирамидальная | SnCl5− | ||
| 5 | квадратная пирамидальная | InCl52− в (NEt4)2InCl5 | ||
| 6 | октаэдр | Fe(H2O)62+ | Na и Cl в хлориде натрия | |
| 6 | тригональная призматическая | Mo(SCHCHS)3 | As в NiAs, Mo в MoS2 | |
| 7 | пентагональная бипирамидальная | ZrF73− в (NH4)3ZrF7 | Pa в PaCl5 | |
| 7 | гранецентрированная октаэдрическая | [HoIII(PhCOCHCOPh)3(H2O)] | La в La2O3 | |
| 7 | тригональная призматическая, квадратическая моногранецентрированная | TaF72− в K2TaF7 | ||
| 8 | куб | Хлорид цезия, фторид кальция | ||
| 8 | квадратная антипризматическая | TaF83− в Na3TaF8 | Хлорид тория(IV) | |
| 8 | Mo(CN)84− в K4[Mo(CN)8].2H2O | Zr в K2ZrF6 | ||
| 8 | гексагональная бипирамидальная | N в Li3N | ||
| 8 | октаэдр | Ni в арсениде никеля | ||
| 8 | Ca в CaFe2O4 | |||
| 8 | тригональная призматическая, квадратная лицевая двуребристая | PuBr3 | ||
| 9 | тригональная призматическая, квадратная лицевая триребристая | [ReH9]2− в нонагидроренате калия | SrCl2·6H2O , Th в RbTh3F13 | |
| 9 | англ. monocapped square antiprismatic | [Th(торополонат)4(H2O)] | La в LaTe2 | |
| 10 | англ. bicapped square antiprismatic | Th(C2O4)42− | ||
| 11 | Th в [ThIV(NO3)4(H2O)3] (NO3−) | |||
| 12 | икосаэдр | Th в Th(NO3)62−-ион в Mg[Th(NO3)6]·8H2O | ||
| 12 | кубооктаэдрон | ZrIV(η³−(BH4)4) | ||
| 12 | ||||
| 14 | двуребристая антипризматичная гексагональная | U(BH4)4 |
Где нет дискретных комплексов означает, что соединения найдены как отдельные единицы сфер вокруг атомов в кристаллах
Произвольный набор атомов
Тень обратной решетки интенсивности граненого углеродного пентакона, состоящего из 118 атомов, загорается красным при дифракции при пересечении сферы Эвальда.
Один путь к обратной решетке произвольного набора атомов происходит от идеи рассеянных волн в пределах Фраунгофера (дальнего расстояния или задней фокальной плоскости линзы) как суммы амплитуд в стиле Гюйгенса от всех точек рассеяния (в этот случай от каждого отдельного атома). Эта сумма обозначается комплексной амплитудой F в приведенном ниже уравнении, потому что это также преобразование Фурье (как функция пространственной частоты или обратного расстояния) эффективного потенциала рассеяния в прямом пространстве:
- Fг→знак равно∑jзнак равно1Nжjг→е2πяг→⋅р→j.{\ Displaystyle F = \ sum _ {j = 1} ^ {N} f_ {j} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {j}}.}
Здесь g = q / (2π) – вектор рассеяния q в единицах кристаллографа, N – число атомов, f j – атомный коэффициент рассеяния для атома j и вектор рассеяния g , а r j – положение вектора атом j
Обратите внимание, что фаза Фурье зависит от выбора начала координат.. Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где
(часkл){\ displaystyle (hkl)}
Для частного случая бесконечного периодического кристалла амплитуда рассеяния F = MF hkl от M элементарных ячеек (как и в случаях выше) оказывается ненулевой только для целых значений , где
(часkл){\ displaystyle (hkl)}
- Fчасkлзнак равно∑jзнак равно1мжjгчасkле2πя(частыj+kvj+лшj){\ displaystyle F_ {hkl} = \ sum _ {j = 1} ^ {m} f_ {j} \ left e ^ {2 \ pi i \ left (hu_ {j} + kv_ {j} + lw_ {j} \ right)}}
когда j = 1, m атомов внутри элементарной ячейки, дробные индексы решетки которых равны соответственно {u j , v j , w j }. Конечно, чтобы учесть эффекты, связанные с конечным размером кристалла, вместо этого следует использовать свертку формы для каждой точки или приведенное выше уравнение для конечной решетки.
Независимо от того, является ли массив атомов конечным или бесконечным, можно также представить себе “обратную решетку интенсивности” I [ g ], которая связана с решеткой амплитуд F через обычное соотношение I = F * F, где F * – комплексное сопряжение F Поскольку преобразование Фурье обратимо, конечно, этот акт преобразования в интенсивность отбрасывает «всю информацию, кроме 2-го момента» (то есть фазы). Таким образом, для случая произвольного набора атомов обратная решетка интенсивности имеет вид:
- яг→знак равно∑jзнак равно1N∑kзнак равно1Nжjг→жkг→е2πяг→⋅р→jk.{\ displaystyle I = \ sum _ {j = 1} ^ {N} \ sum _ {k = 1} ^ {N} f_ {j} \ left f_ {k} \ left e ^ {2 \ pi i {\ vec {g}} \ cdot {\ vec {r}} _ {jk}} .}
Здесь r jk – векторное расстояние между атомом j и атомом k. Это также можно использовать для прогнозирования влияния формы нанокристаллита и тонких изменений ориентации луча на обнаруженные дифракционные пики, даже если в некоторых направлениях толщина кластера составляет всего один атом. С другой стороны, расчеты рассеяния с использованием обратной решетки в основном учитывают падающую плоскую волну. Таким образом, после первого взгляда на эффекты обратной решетки (кинематического рассеяния), уширение луча и эффекты многократного рассеяния (т.е. динамические ) также могут быть важны для рассмотрения.
Границы зерен
Границы зерен – это границы раздела, на которых встречаются кристаллы разной ориентации. Граница зерна представляет собой однофазный интерфейс, с кристаллами на каждой стороне границы являются идентичными , за исключением ориентации. Иногда, хотя и редко, используется термин «граница кристаллита». Области границ зерен содержат те атомы, которые были возмущены из своих исходных узлов решетки, дислокации и примеси, которые мигрировали к границе зерен с более низкой энергией.
Рассматривая границу зерна геометрически как границу раздела монокристалла, разрезанного на две части, одна из которых вращается, мы видим, что для определения границы зерна требуется пять переменных. Первые два числа берутся из единичного вектора, определяющего ось вращения. Третье число обозначает угол поворота зерна. Последние два числа определяют плоскость границы зерна (или единичный вектор, перпендикулярный этой плоскости).
Границы зерен нарушают движение дислокаций в материале, поэтому уменьшение размера кристаллитов является обычным способом повышения прочности, как описано соотношением Холла – Петча . Поскольку границы зерен являются дефектами кристаллической структуры, они имеют тенденцию уменьшать электрическую и теплопроводность материала. Высокая межфазная энергия и относительно слабая связь в большинстве границ зерен часто делают их предпочтительными участками для начала коррозии и выделения новых фаз из твердого тела. Они также важны для многих механизмов ползучести .
Границы зерен обычно имеют ширину всего несколько нанометров. В обычных материалах кристаллиты достаточно велики, чтобы границы зерен составляли небольшую часть материала. Однако достижимы очень маленькие размеры зерен. В нанокристаллических твердых телах границы зерен становятся значительной объемной долей материала, что оказывает сильное влияние на такие свойства, как диффузия и пластичность . В пределе мелких кристаллитов, когда объемная доля границ зерен приближается к 100%, материал перестает иметь какой-либо кристаллический характер и, таким образом, становится аморфным твердым телом .
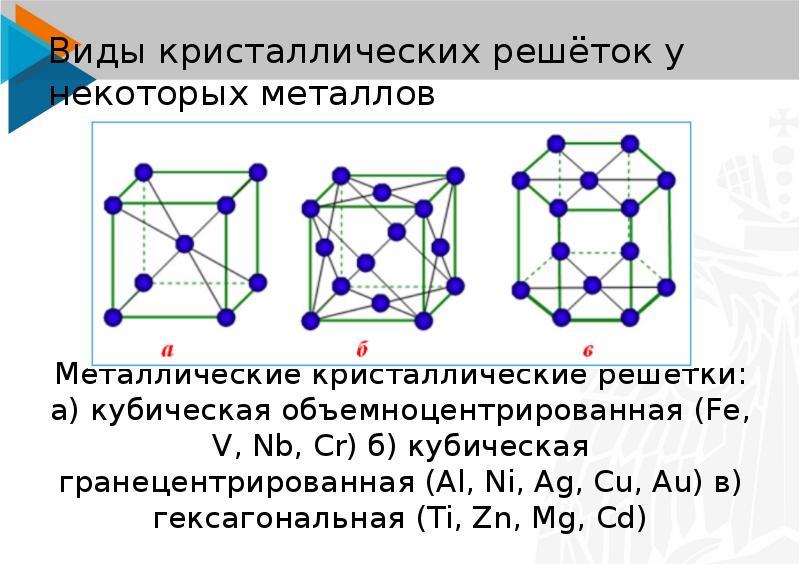
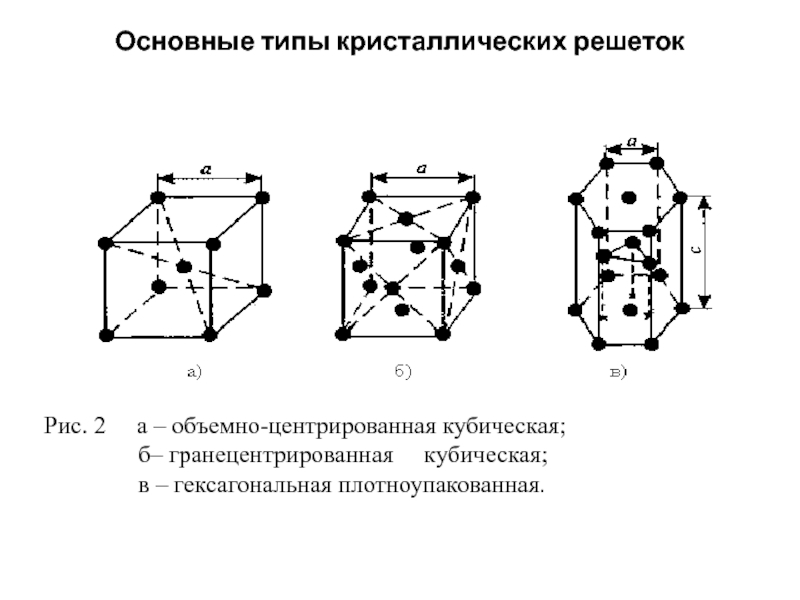
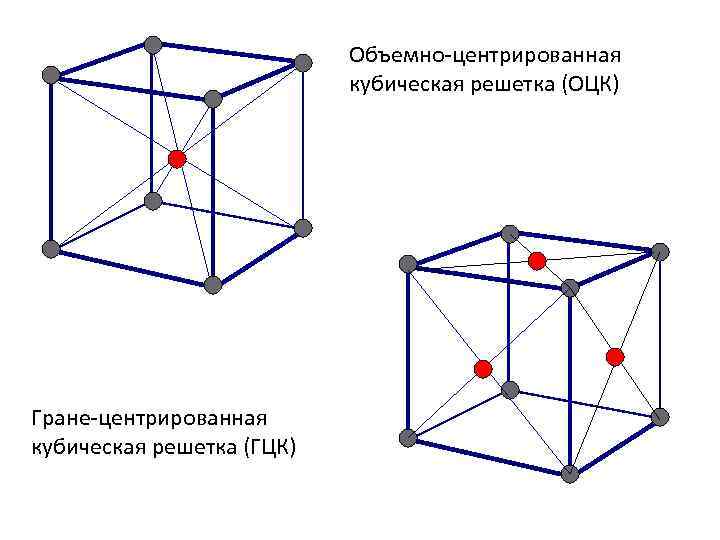
А) объемноцентрированная кубическая
б) гранецентрированная кубическая
в) гексагональная плотноупакованная
Некоторые металлы, в зависимости от температуры, могут иметь различный тип кристаллической решётки, т.е. могут существовать в различных кристаллических модификаций.
Полиморфизм (аллотропия) – когда металл имеет разную кристаллическую решётку в зависимости от условия образования. Переход одной решётки в другую называется полиморфное или аллотропическое состояние. Полиморфные превращения в металлах происходят при изменении температуры. Так, при температуре свыше 723°С железо переходит из α – модификации в γ – модификацию, при этом изменяются физико-механические свойства металла.
Чтобы отличить одну кристаллическую решётку железа Fe от другой ставят значок α или γ
В монокристаллах свойства металла по различным направлениям различны – это явление носит название анизотропией.
В реальных поликристаллических металлах свойства по любому направлению одинаково – это явление называется изотропией.
Металлы обладают целым рядом общих свойств:
Высокая электо- и теплопроводимость
Характерный металлический блеск
Положительный коэффициент электросопротивления
Способность к значительной пластической деформации
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. В каждую эпоху предпочтение отдавалось разным видам этих удивительных веществ. Так, IV-III тысячелетия до нашей эры считаются веком хальколита, или медным. Позже его сменяет бронзовый, а затем в силу вступает тот, что и по сей день является актуальным — железный.
Сегодня вообще сложно представить, что когда-то можно было обходиться без металлических изделий, ведь практически все, начиная от предметов быта, медицинских инструментов и заканчивая тяжелой и легкой техникой, состоит из этого материала или включает в свой состав отдельные части из него. Почему же металлы сумели завоевать такую популярность? В чем проявляются особенности и как это заложено в их строении, попробуем разобраться далее.
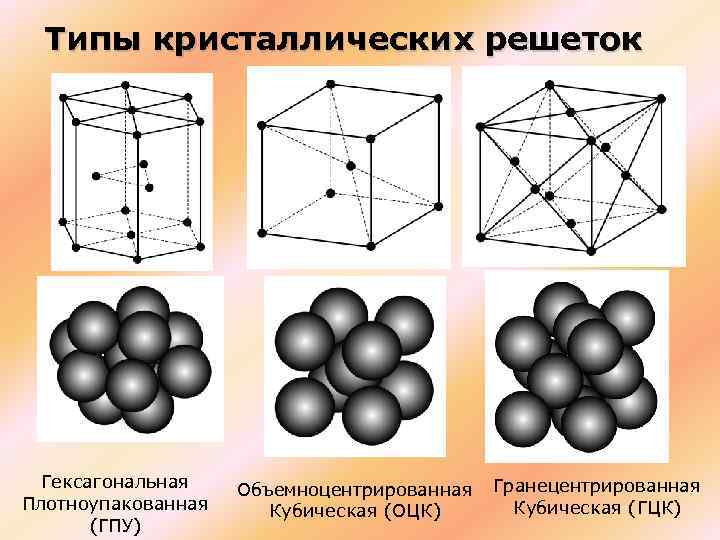
Виды решёток
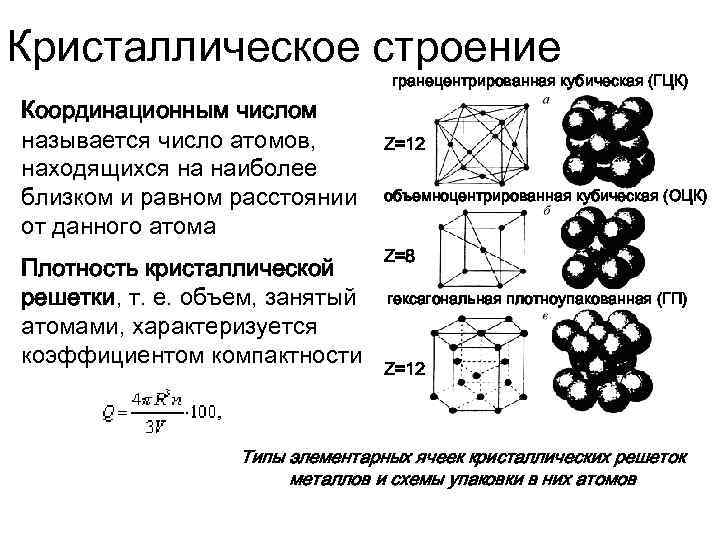
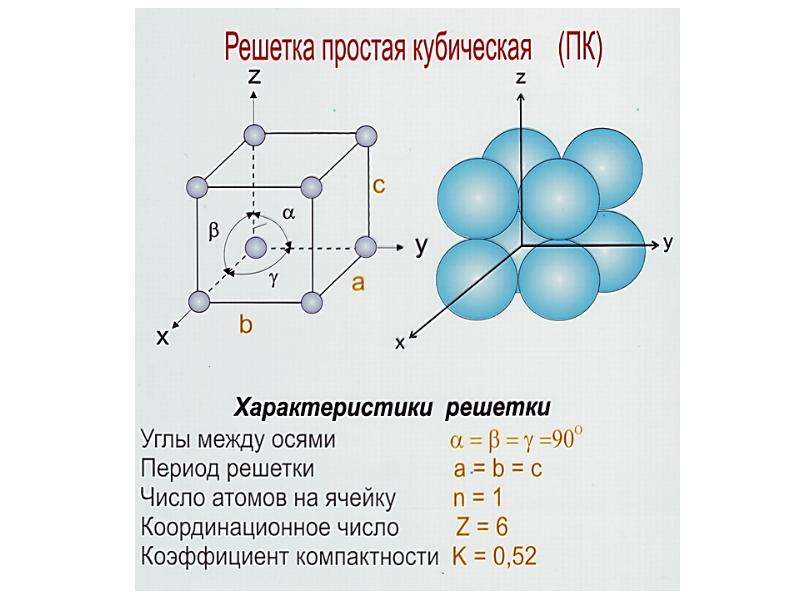
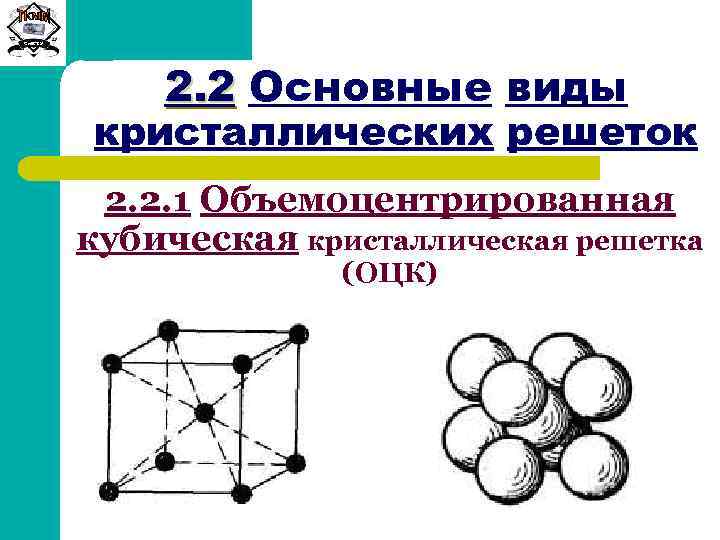
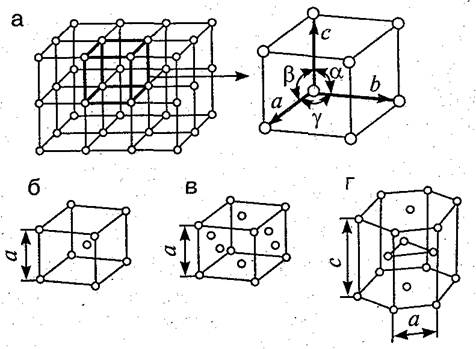
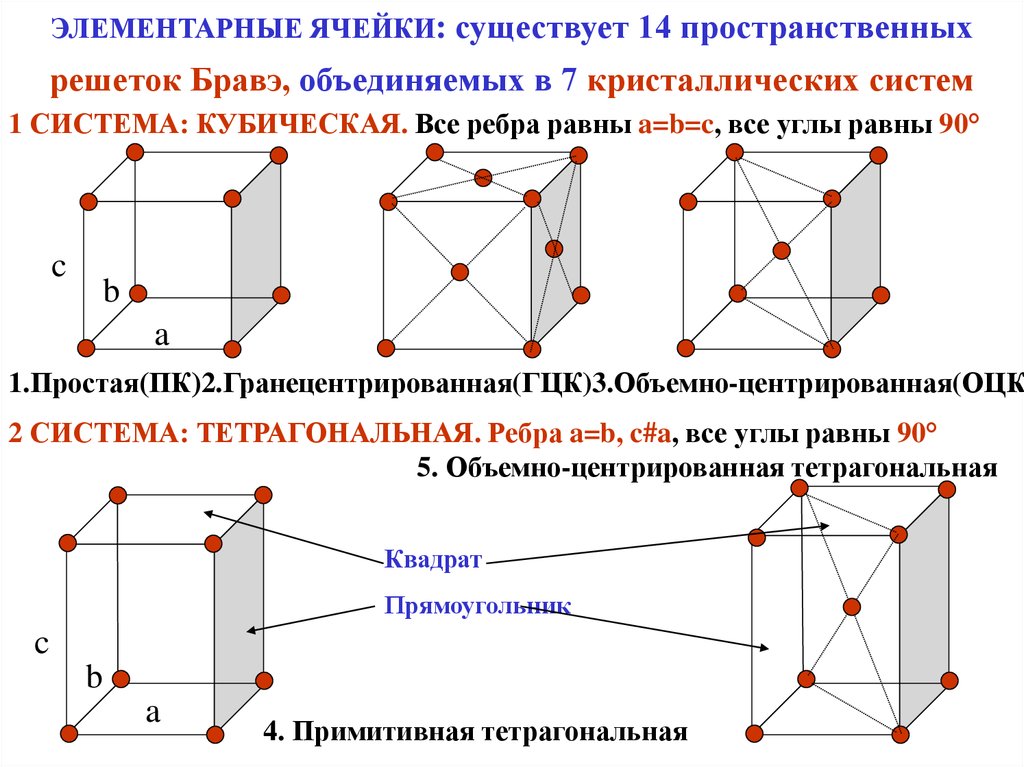
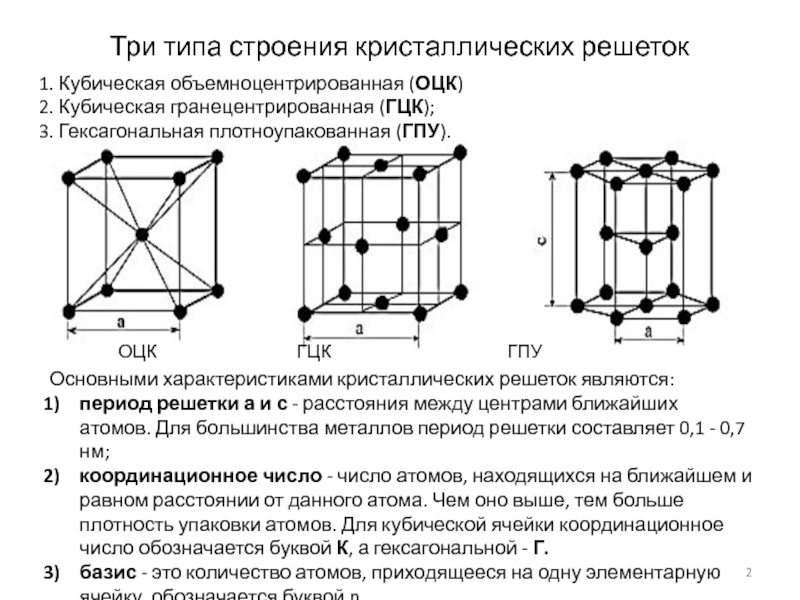
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
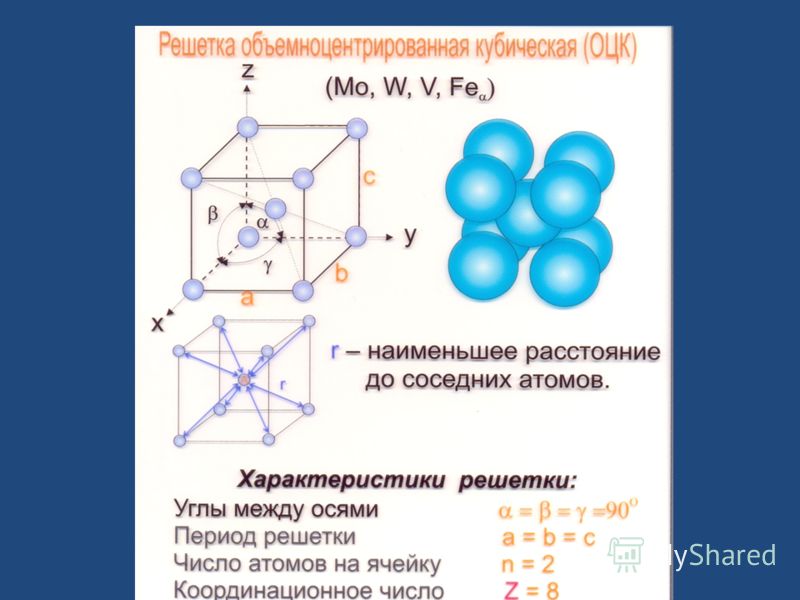
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
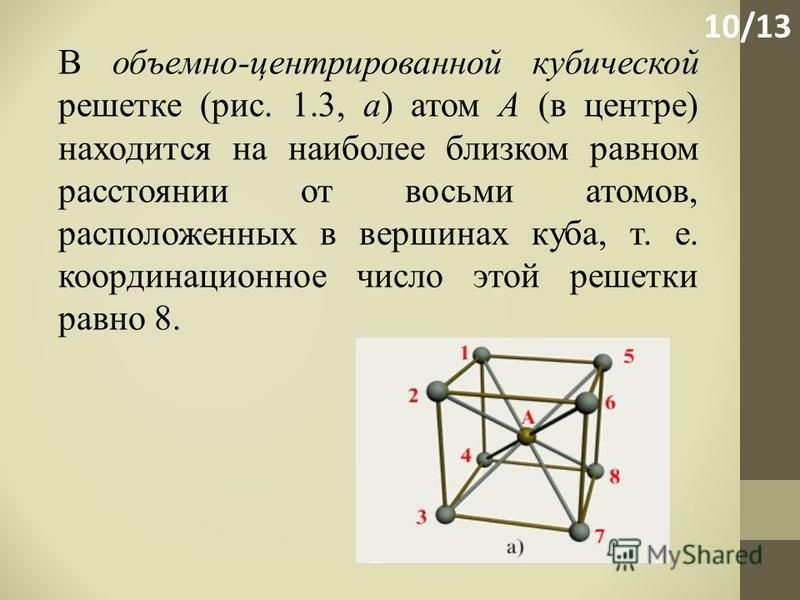
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
Рис. 2. Типы решёток.
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
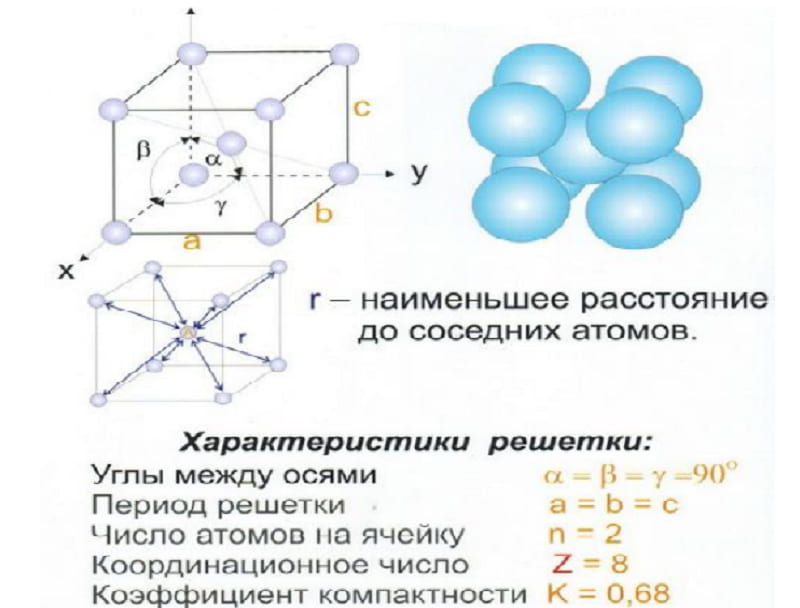
З. Гексагональная плотноупакованная решетка (ГПУ)
Рис.1.5
В гексагональной плотноупакованной решетке (рис.1.5) атомы расположены в вершинах и в центре шестигранных оснований призмы, а три атома – в средней плоскости призмы. Ячейка ГПУ решетки содержит 17 атомов.
Гексагональную кристаллическую решетку имеют магний, кадмий, цинк и другие металлы.
Некоторые металлы могут изменять тип кристаллической решетки при изменении температуры (при нагреве, либо охлаждении). Такие металлы называются полиморфными.
Явление полиморфизма – изменение типа кристаллической решетки при изменении температуры.
Реальное строение металлов и сплавов
Идеальная кристаллическая решетка представляет собой многократное повторение элементарных кристаллических ячеек. Таких кристаллов в природе практически не существует. Их можно создать только в лабораторных условиях (их называют металлические усы, т.к. их толщина соответствует нескольким межатомным расстояниям).
В реальных кристаллах всегдаприсутствуют дефекты кристаллического строения, которые нарушают периодичность расположения атомов в кристаллической решетке. Эти дефекты оказывают существенное влияние на свойства материалов.
Различают два вида дефектов кристаллического строения: точечные и линейные.
Точечные дефекты характеризуются малыми размерами во всех трех измерениях. Величина их не превышает нескольких атомных диаметров.
К точечным дефектам относятся :
— вакансии ( свободные места в узлах кристаллической решетки (рис.1.6);
— атомы внедрения и замещения (примесные атомы, которые могут находиться и в узлах решетки, и в междоузлии, рис.1.7 а, б)
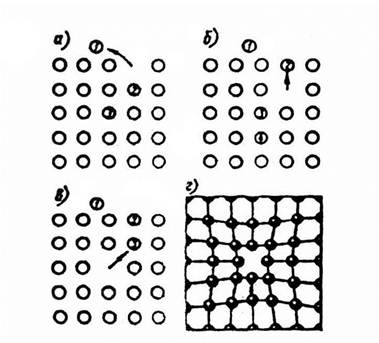
Рис.1.6. Вакансии
Атомы совершают колебательные движения возле узлов решетки. Под воздействием внешних воздействий (например, температуры) отдельные атомы приобретают энергию, значительно большую, чем средняя энергия соседних атомов в решетке. Эти атомы могут перемещаться из одного места в другое. Наиболее легко перемещаются атомы поверхностного слоя, выходя на поверхность. Место, где находились такие атомы, называется вакансией (рис.1.6). На это место перемещается один из соседних атомов и т.д. Таким образом, вакансия перемещается вглубь кристалла.
При комнатной температуре концентрация вакансий сравнительно невелика и составляет около 1 на 1018 атомов, но количество вакансий в кристаллической решетке резко возрастает при нагреве и может достигать огромных величин. Так, например, в решетке некоторых металлов в 1 см3 количество вакансий может достигать 1013.
К точечным дефектам относят также атомы, внедренные в междоузлие кристаллической решетки (рис.1.7 а) и замещенные атомы, когда место атома основного металла замещается в кристаллической решетке атомом другого элемента (рис.1.7 б).
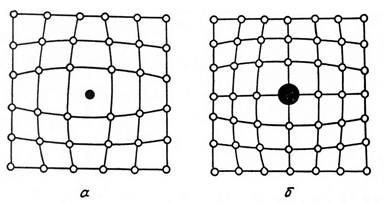
Рис. 1.7. Примесные атомы внедрения (а) и замещения (б).
Точечные дефекты приводят к локальным искажениям в кристаллической решетке и локальным изменениям межатомных связей. С увеличением количества точечных дефектов может возрастать сопротивление кристаллической решетки дальнейшему смещению атомов.
С другой стороны, присутствие вакансий в решетке объясняет возможность такого физического процесса, как диффузия.
Заполнение оставшегося места
ГЦК- и ГПУ-упаковки – это самые плотные известные упаковки из одинаковых сфер с наивысшей симметрией (наименьшие повторяющиеся единицы). Известны более плотные упаковки сфер , но они включают . Плотность упаковки 1, полностью заполняющая пространство, требует несферической формы, такой как соты .
Замена каждой точки контакта между двумя сферами ребром, соединяющим центры соприкасающихся сфер, дает тетраэдры и октаэдры с равной длиной ребра. Расположение ГЦК дает четырехгранно-октаэдрические соты . Компоновка ГПУ образует спиральные четырехгранно-октаэдрические соты . Если вместо этого каждая сфера дополнена точками в пространстве, которые ближе к ней, чем к любой другой сфере, образуются двойники этих сот: ромбические додекаэдрические соты для ГЦК и трапеции-ромбические додекаэдрические соты для ГПУ.
Сферические пузырьки появляются в мыльной воде в виде ГЦК или ГПУ, когда вода в промежутках между пузырьками стекает. Этот образец также приближается к ромбическим додекаэдрическим сотам или трапециевидным додекаэдрическим сотам . Однако такие пены с ГЦК или ГПУ с очень малым содержанием жидкости нестабильны, поскольку не удовлетворяют законам Плато . Пены Кельвина и пена Weaire-Фелэно являются более стабильными, имеющей меньшей межфазной энергией в пределе очень малого содержания жидкости.
Именование неорганических соединений[править | править код]
ИЮПАК ввел полиэдрический символ (англ. Polyhedral symbol) в части «рекомендации номенклатуры по ИЮПАК в неорганической химии 2005» (англ. IUPAC nomenclature of inorganic chemistry 2005 recommendations) для описания геометрии вокруг атома в соединении.
IUCr (International Union of Crystallography) предложили символ, который показывается как верхний индекс в квадратных скобках в химической формуле. Например, CaF2 будет записан как CaF2, где означает что это кубическая координация и означает — четырехгранная. Эквивалентный символ в ИЮПАК обозначается как CU−8 и T-4 соответственно.
Символ ИЮПАК применим к комплексам и молекулам, в то время как по предложению IUCr это относится к кристаллическим твердым телам.
литература
- Международные таблицы для кристаллографии . Том A: Тео Хан (Ред.): Пространственно-групповая симметрия. Kluwer Academic Publishing Company, Dordrecht et al., 1983, ISBN 90-277-1445-2 .
- Д. Шварценбах: Кристаллография. Спрингер, Берлин и др. 2001, ISBN 3-540-67114-5 .
- Уолтер Борчард-Отт: Кристаллография. Введение для ученых. Издание 7-е исправленное и дополненное. Springer, Berlin et al.2009, ISBN 978-3-540-78270-4 .
- Уилл Клебер , Ханс-Иоахим Бауч , Иоахим Бом , Детлеф Климм: Введение в кристаллографию . 19-е издание. Oldenbourg Wissenschaftsverlag, Мюнхен 2010, ISBN 978-3-486-59075-3 .