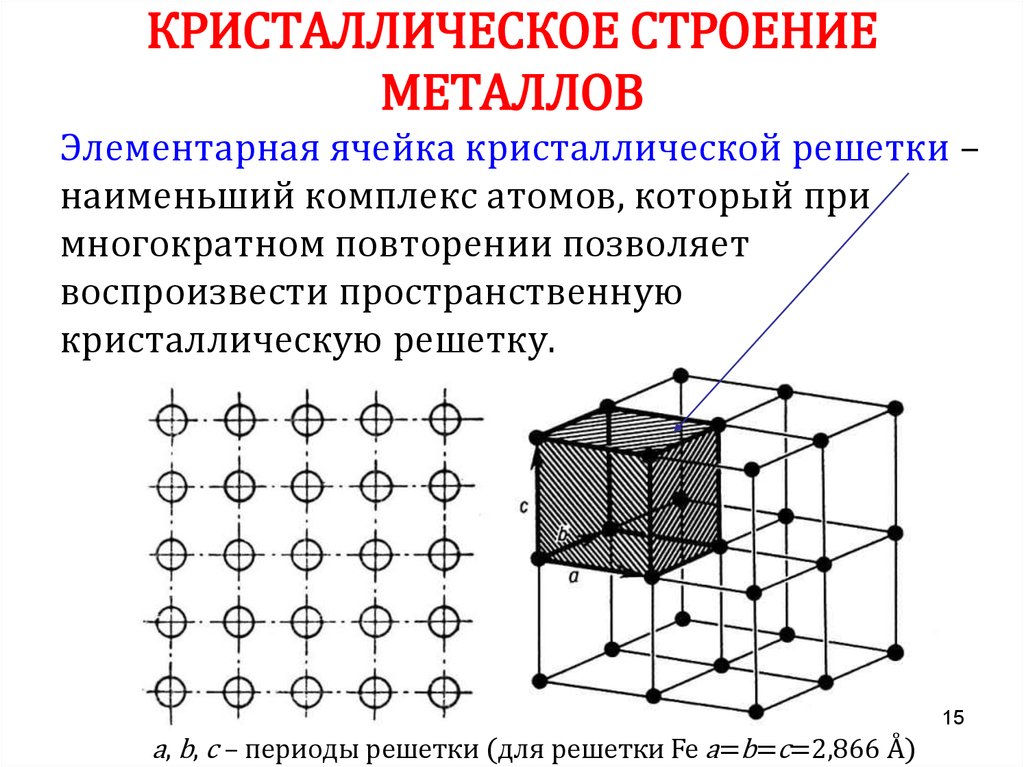
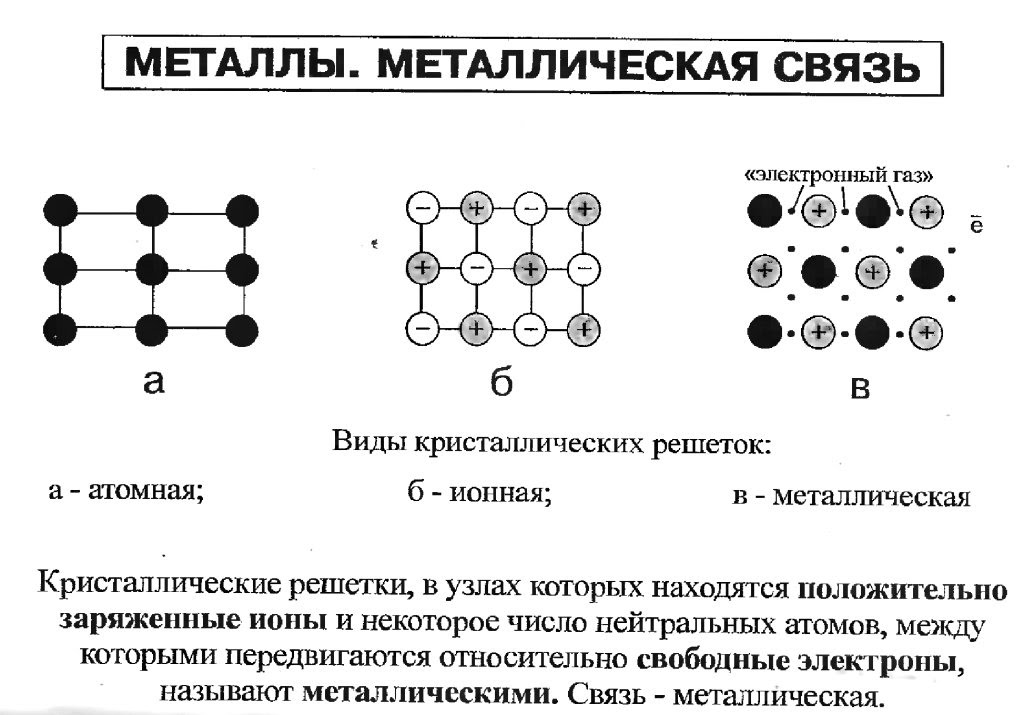
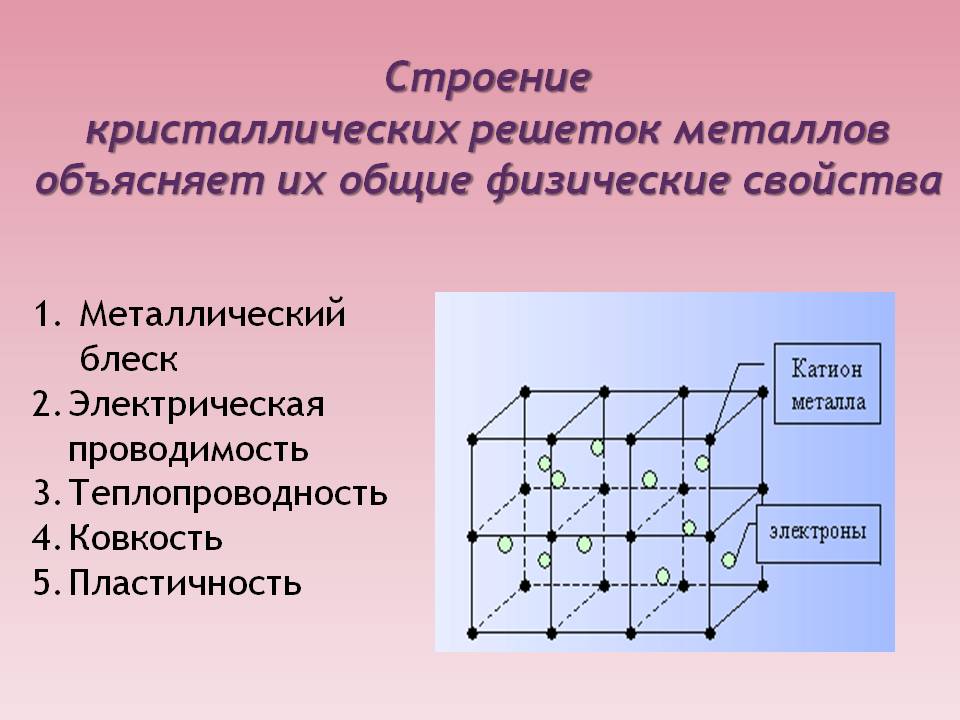
Особенности строения кристаллической решетки металлов металлический блеск
Найдите по таблице два металла с объемно-центрированной и гранецентрированной упаковкой с близкими температурами плавления (максимальное отличие 20 градусов). Посчитайте отношение их коэффициентов линейного расширения. Значение запишите с точностью до второго знака после запятой.
Прочитайте текст и выполните задания 16—18.
Одним из самых распространенных материалов, с которым всегда предпочитали работать люди, был металл. Все металлы имеют ряд свойств, которые позволяют объединять их в одну большую группу веществ. В свою очередь, эти свойства объясняет кристаллическое строение металлов. К специфическим свойствам рассматриваемых веществ относят следующие:
1. Металлический блеск. Все представители простых веществ им обладают, причем большинство одинаковым серебристо-белым цветом. Лишь некоторые (золото, медь, сплавы) отличаются.
2. Ковкость и пластичность — способность деформироваться и восстанавливаться достаточно легко. У разных представителей выражена в неодинаковой мере.
3. Электропроводность и теплопроводность — одно из основных свойств, которое определяет области применения металла и его сплавов.
Кристаллическое строение металлов и сплавов объясняет причину каждого из обозначенных свойств и говорит о выраженности их у каждого конкретного представителя. Если знать особенности такого строения, то можно влиять на свойства образца и подстраивать его под нужные параметры, что и делают люди уже многие десятилетия.
Связь между коэффициентами линейного расширения,
температурами плавления металлов и симметрией
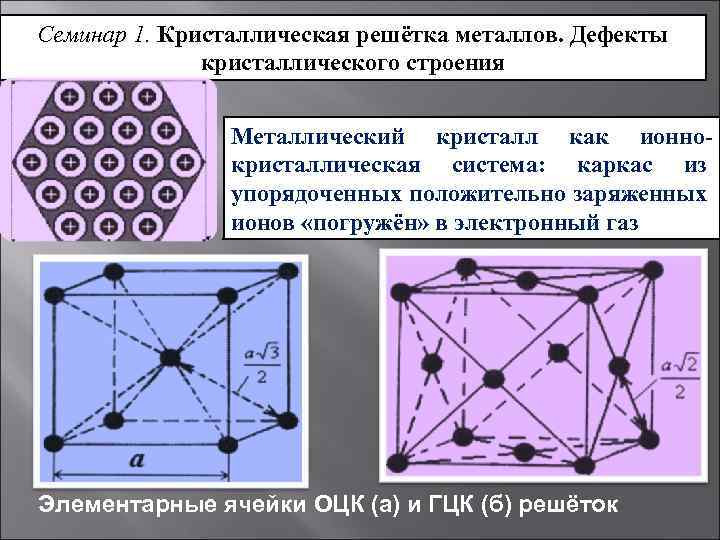
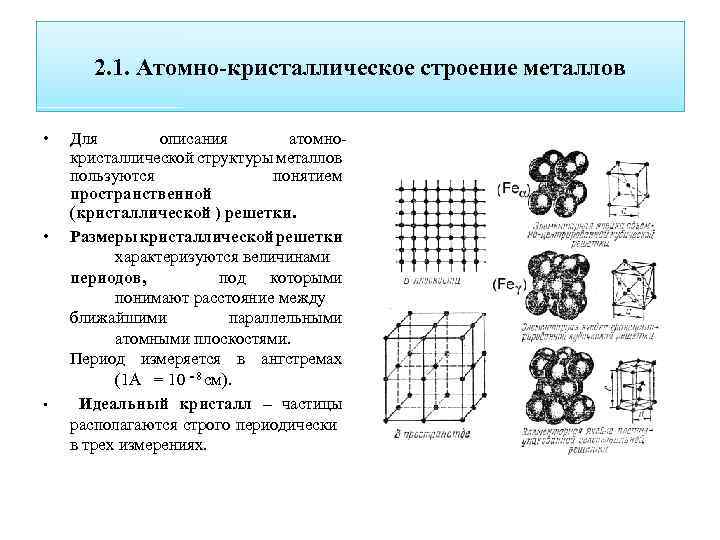
Кристалл — это условное графическое изображение, построенное путем пересечения воображаемых линий через атомы, которые выстраивают тело. Другими словами, каждый металл состоит из атомов. Они располагаются в нем не хаотично, а очень правильно и последовательно. Так вот, если мысленно соединить все эти частицы в одну структуру, то получится изображение в виде правильного геометрического тела какой-либо формы. Это и принято называть кристаллической решеткой металла. Она очень сложная и пространственно объемная, поэтому для упрощения показывают не всю ее, а лишь часть, элементарную ячейку. Совокупность таких ячеек, собранная вместе и отраженная в трехмерном пространстве, и образует кристаллические решетки.
Сама элементарная ячейка – это набор атомов, которые располагаются на определенном расстоянии друг от друга и координируют вокруг себя строго фиксированное число других частиц. Она характеризуется плотностью упаковки, расстоянием между составными структурами, координационным числом. В целом все эти параметры являются характеристикой и всего кристалла, а значит, отражают и проявляемые металлом свойства. Существует несколько разновидностей кристаллических решеток. Объединяет их все одна особенность – в узлах находятся атомы, а внутри располагается облако электронного газа, которое формируется путем свободного передвижения электронов внутри кристалла.
Какие металлы бывают?
Металлы в периодической системе Менделеева делятся на несколько групп. Перечислим и кратко охарактеризуем их:
- Щелочные. Эти металлы имеют всего 1 валентный электрон, они чрезвычайно химически активны, имеют низкую плотность и являются отличными проводниками тепла и электричества. Примерами их являются литий, натрий и калий.
- Щелочноземельные. К ним относятся кальций, магний, стронций. Эти металлы имеют 2 валентных электрона, поэтому они также являются химически активными.
- Переходные. Это металлы с переменной валентностью, которые имеют пустые или полупустые орбитали d и f типа. Это самая многочисленная группа металлов. К ним относятся титан, ванадий, хром, никель, вольфрам, осмий, золото и многие другие.
- Лантаноиды и актиноиды. Большая часть этих элементов является нестабильными и проявляет различную степень радиоактивности.
- Постпереходные. Это те элементы, после которых по периоду идут металлоиды, а затем неметаллы. Самыми известными из них являются свинец, алюминий и олово.
Что такое медь? Свойства, история и происхождение меди
История меди
Добрый день, уважаемый читатель, в данной статье хочу рассказать о меди и её свойствах. Что такое медь? Ответ на этот вопрос знают почти все. Она имеет обозначение Cu (произносится купрум) в таблице В. И. Менделеева находится под атомным номером 29. Медь – химический элемент, представляет собой металл. Название меди Cuprum является латинским и происходит от названия острова Кипр.
Данный металл широко применяется человеком уже долгие годы. Имеются достоверные факты о том, что индейцы, жившие в Эквадоре уже в XV веке умели добывать и использовать медь. Из неё они изготовляли монеты в виде топориков.

Данная монета очень продолжительное время являлась единственным денежным знаком, который существовал на побережье Южной Америки. Эта монета даже использовалась в торговле с инками. На острове Кипр, в III веке до нашей эры уже были открыты медные рудники. Известен интересный факт, что древние алхимики называли медь — венера (Venus).

Происхождение меди
Медь в природе встречается либо в самородках, либо в соединениях. Особое значение в промышленности имеют халькозин, борнит и медный колчедан. Однако и такие популярные в ювелирном деле поделочные самоцветы, как лазурит и малахит практически на сто процентов состоят из меди.
Медь имеет золотисто – розовую окраску. На воздухе этот металл очень быстро окисляется и покрывается оксидной плёнкой, которая называется патина. Именно из-за патины медь приобретает желтовато – красный цвет. Этот металл входит в состав очень многих сплавов, которые широко используются в промышленности.
Распространённые сплавы меди
Самым известным сплавом является дюралюминий, который состоит из сплава меди и алюминия. Медь в дюралюминии играет главную роль. Мельхиор также содержит медь в соединении с никелем, бронза – соединение олова и меди, латунь – сплав меди с цинком.
Медь обладает довольно высокой тепло и электропроводностью. По сравнению с другими металлами, она занимает второе место после серебра по электропроводности. В ювелирном производстве часто используют сплавы золота с медью. Медь в данном сплаве нужна для увеличения прочности ювелирных украшений к деформациям и истиранию.

В давние времена был известен сплав меди с оловом и цинком, который назывался пушечный металл. Как вы уже, наверно, догадались, что из данного сплава изготавливали пушечные ядра, но с развитием новых технологий, пушки перестали использовать и выпускать, однако данный сплав по сей день используется в производстве оружейных гильз.

Медь имеет бактерицидные свойства и поэтому она широко применяется в медицине, которые очень часто применяются в медицине. Данный факт доказан научными экспериментами и исследованиями. Особенно хорошо медь противостоит золотистому стафилококку. Этот микроб вызывает большое количество гнойных заболеваний кожи.
Токсичность меди
В тоже время известны факты того, что медь бывает очень токсичной. На планете Земля существует озеро Беркли Пит, оно находится в США в штате Монтана. Так вот это озеро считается самым токсичным в мире. Причиной тому является медный рудник, на месте которого образовалось озеро.

Вода в озере очень токсична, в ней почти нет живых организмов, а глубина озера составляет более 0,5 километра. Сильную токсичность воды доказывает один пример, который произошёл однажды на озере. Стая диких гусей, состоявшая из 35 взрослых особей, опустилась на водную гладь озера, а через 2,5 часа все птицы были найдены погибшими.

Однако, совсем недавно, на дне озера были обнаружены совсем новые микроорганизмы и водоросли, которые не встречались ранее в природе. В результате мутаций, данные жители хорошо себя чувствуют в токсичной воде озера.
Что такое металл и чем он отличается от неметалла?
Иными словами, как можно понять, что перед нами находится металлический материал? Ответы на все эти вопросы можно получить, если рассмотреть уникальные свойства металлов. К ним относятся следующие основные:
- Наличие металлического блеска при полировке поверхности. Все металлы блестят, в своем большинстве они имеют серый цвет, однако, некоторые металлы обладают специфической окраской, например, висмут розовый, медь красноватая, а золото желтое.
- Высокая теплопроводность и электропроводность. При комнатной температуре наиболее высокие показатели для этих физических свойств характерны для меди и серебра.
- При комнатной температуре практически все металлы находятся в твердом агрегатном состоянии материи. Исключение составляет ртуть, которая плавится уже при -39 oC.
- Будучи в твердом состоянии, металлы кристаллическим строением характеризуются. Если расплав рассматриваемого материала слишком быстро охлаждать, то он приобретает аморфную структуру, в которой все же сохраняется ближний порядок.
- Температуры плавления и плотности металлов варьируются в широких пределах. Так, элемент вольфрам является самым тугоплавким (3410 oC). Самым же тяжелым считается осмий (в 22,6 раза плотнее воды), а самым легким — литий (почти в 2 раза менее плотный, чем вода).
- Все металлы химически активны. Поскольку они обладают низкой электроотрицательностью, то в химических реакциях их атомы отдают электроны и превращаются в положительно заряженные ионы (катионы).

Выше в списке были перечислены основные свойства металлов, которые их отличают от неметаллических материалов. Примерами последних являются кислород, азот, благородные газы, сера, кремний, углерод и некоторые другие. Заметим, что все живые организмы состоят в основном из неметаллов.
Мир металлов глазами химика. 9 класс. Разработка урока
Урок 2 «Мир металлов глазами химика» является начальным звеном изучения темы «Металлы» (24 часа) по программе О.С. Габриеляна.
В классе есть несколько учащихся, интересующихся химией, предмет привлекателен для них практической направленностью, разнообразием смены деятельности, наглядностью при изучении материала.
Тип урока: изучение нового материала
Вид урока: урок-исследование
Цели урока: изучить положение металлов в П.С.Х.Э., раскрыть причины общих физических свойств металлов.
Виды познавательной деятельности: Постановка проблемы, наблюдение за экспериментом, умение выделять главное, сравнивать, обобщать, логически излагать мысли.
Способы управления познавательной деятельностью: Ознакомление с целями и задачами урока, видом контроля.
Формы организации учебной деятельности:индивидуальная и групповая деятельность, лабораторный опыт.
Методы организации учебной деятельности:беседа, демонстрационный эксперимент, метод проблемная ситуация.
Средства обучения:
- Учебники: О.С. Габриелян «Химия»9 кл.
- Коллекции образцов металлов, алюминиевая фольга, железный гвоздь, спиртовка, елочная игрушка, зеркало, стеклянные пластинки, периодическая система.
- Средства ТСО: компьютер, проектор, экран.
- Программное обеспечение: Power Point.
Организациооный момент. Введение.
Интересные факты-загадки о металлах: (слайд№2)
- Этот элемент особенно нужен растущему детскому организму. У взрослого человека без него ломаются кости, не свертывается кровь, сердце работает плохо. Моллюск без него дома не построит, черепаха без крыши останется, а курице и яйцо упаковать не во что будет. (Кальций)
- Если вы разбили термометр, то не играйте блестящей капелькой. Ее пары ядовиты. (Ртуть)
- Название данного химического элемента с древнеармянского языка переводится как «капнувший с неба», но на нас он уже с неба не капает, хотя наш организм в нем нуждается. (Железо)
- Вещество, образованное данным химическим элементом, обладает бактерицидным действием. Известно, что в древности хранили воду в сосудах, изготовленных из этого вещества, поэтому она долго не портилась. (Серебро)
- Вещество, образованное данным химическим элементом, чрезвычайно стойко химически и в тоже время совместимо с тканями человека. Поэтому он незаменим в восстановительной хирургии. (Тантал)
Вопрос учителя: К какой группе химических элементов относятся перечисленные на слайде? (металлы)
Сообщение темы и цели урока.
II. Подготовка к основному этапу усвоения учебного материала.
Алхимики считали, что» семь металлов создал свет по числу семи планет». Назовите эти элементы и соответствующие им планеты. (Учебник стр. 22)
Выслушав ответы, читаем отрывок из записок алхимика (перевод Н. Морозова):
Вопрос учителя: Что означает слово Металл? Каков его смысл? (слово металл может означать химический элемент и простое вещество.)
Схема:
Учитель: Что такое химический элемент? (совокупность атомов) Совместно с учащимися выясняем особенности строения атомов металлов на основании их положения в ПСХЭ.
Учитель: Если провести диагональ от В к At через элементы главных подгрупп, то по этой диагонали (B-Si-As-Te-At) и над ней будут располагаться неметаллы, а под ней- металлы. В итоге из 110 элементов ПС к металлам относятся 88 элементов. Однако, деление элементов на металлы и неметаллы условно. Так, например, металл германий обладает многими неметаллическими свойствами. Хром, алюминий и цинк — типичные металлы, но образуют соединения, в которых проявляют неметаллические свойства: NaAlO2, K2ZnO2, K2CrO4, K2Cr2O7. Из положения металлов в ПС можно определить и особенности строения их атомов: (слайд №3)
- Небольшое число электронов на внешнем уровне.
- Сравнительно большой атомный радиус
- Способность отдавать внешние электроны и проявлять восстановительные свойства. (Проблема: почему бор, атомы которого имеют три электрона на внешнем уровне, но проявляют типичные неметаллические свойства?)
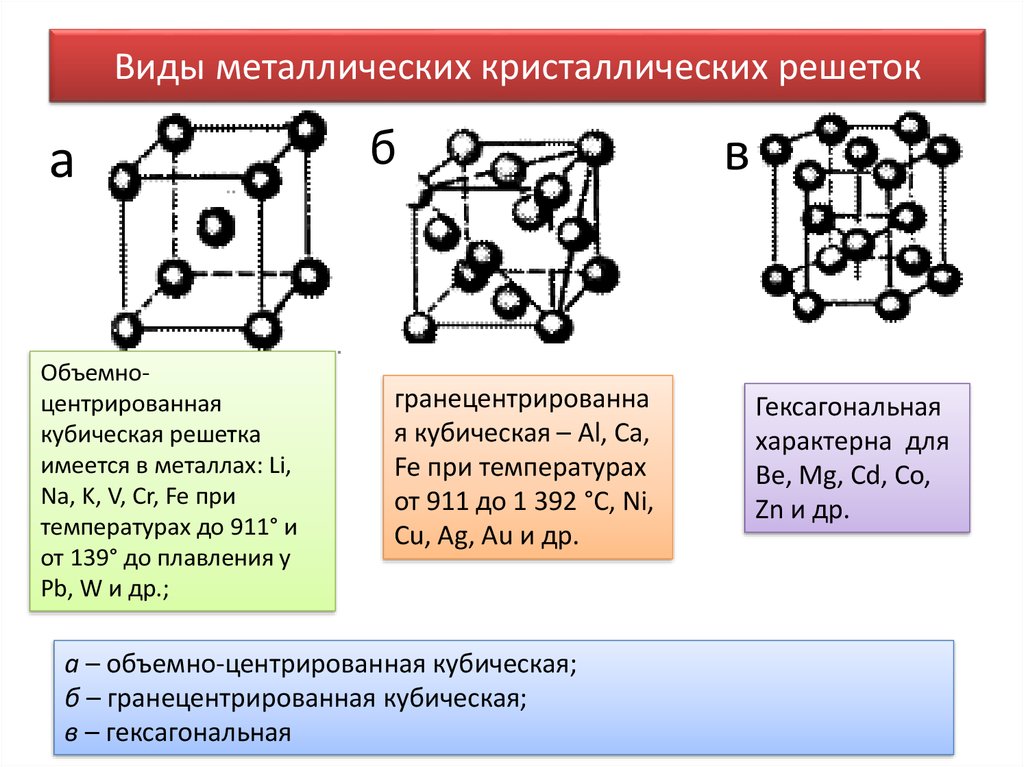
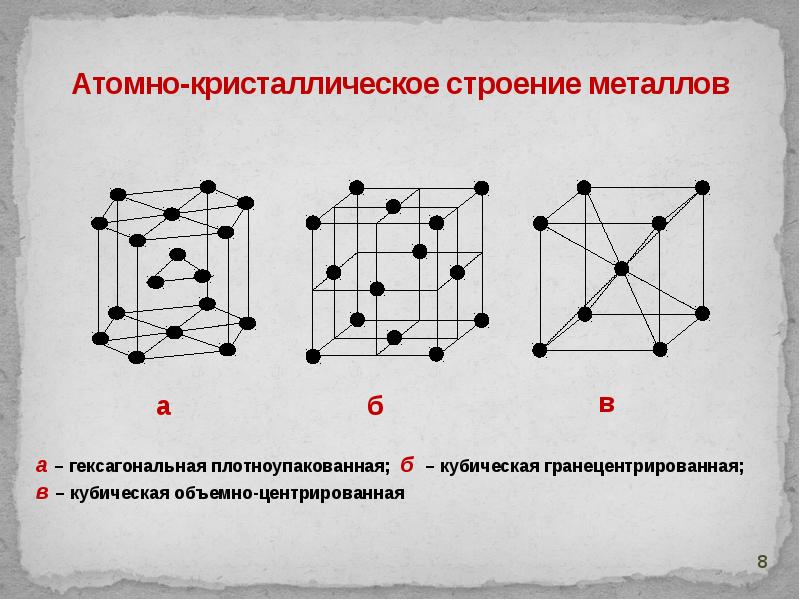
Основные типы кристаллических решёток металлов
Чтобы поделиться, нажимайте
Основные типы кристаллических решёток металлов
Физические свойства металлов определяются их электронным строением и природой кристаллической решётки.
Поскольку металлическая связь ненасыщаема и ненаправлена, для металлов характерны кристаллические структуры с высокими координационными числами (количество атомов, которое окружает один атом). Как правило, металлы кристаллизуются в одном из трёх типов решёток, для двух из них координационное число равно 12, а для третьей – 8.
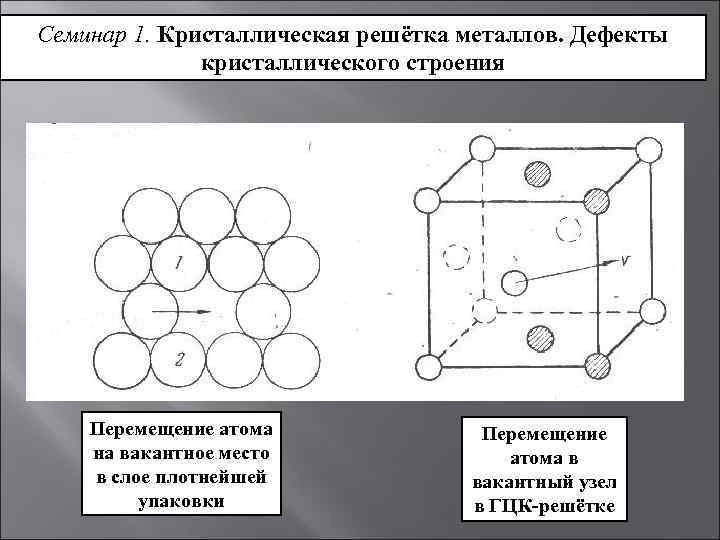
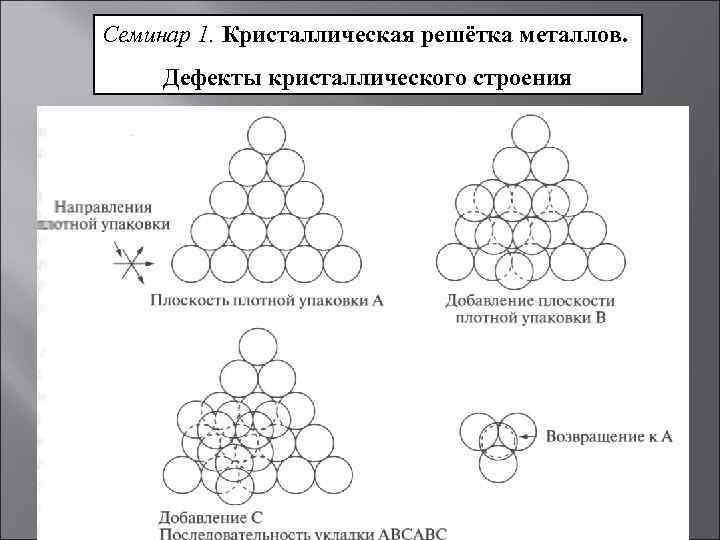
Строение первых двух кристаллических решёток можно представить следующим образом. Мысленно положим шарообразные атомы металлов на стол и плотно придвинем их друг к другу. Мы заметим, что каждый шар окажется в окружении шести соседних шаров (на рисунке ниже – а).
Затем положим сверху на первый слой шаров (А) второй слой (В) так, чтобы шары второго слоя попали в углубления между шарами первого слоя (на рисунке выше – б). Проделаем то же самое, укладывая сверху шары третьего слоя. Укладка шаров третьего слоя возможна двумя различными способами. Однако это не влияет на координационное число, но в результате образуются две неодинаковые структуры.
Первый способ приводит к расположению шаров третьего слоя в точности над шарами первого слоя (на рисунке выше –в). Такая структура называется гексагональной плотнейшей упаковкой (ГПУ) и состоит из чередующихся слоёв атомов металла АВАВ. Слово «гексагональный» означает шестиугольный и указывает, что каждый шар в своём слое окружён шестиугольником ближайших соседей.
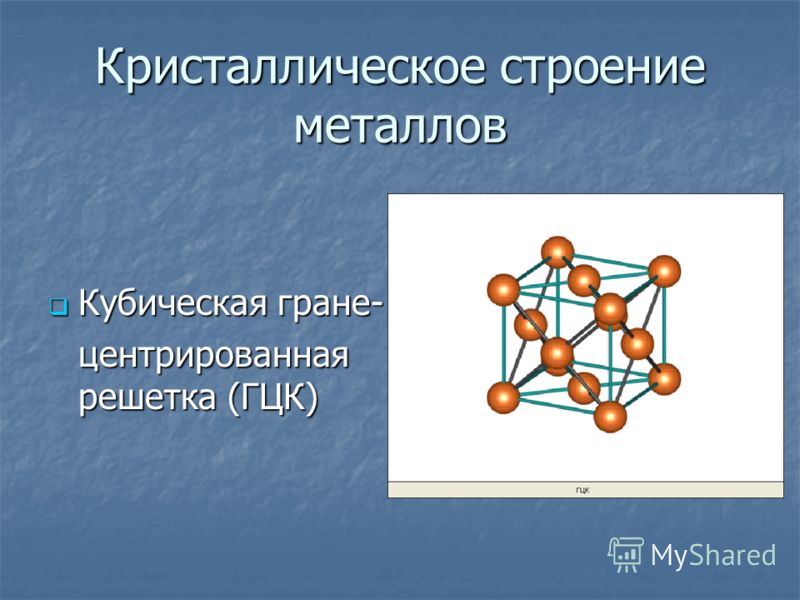
Второй способ отличается от первого тем, что расположение шаров третьего слоя С повернуто на 60 градусов вокруг вертикальной оси по отношению к первому слою (на рисунке выше – г). При этом шары третьего слоя оказываются над углублениями между шарами первого слоя. В таком случае только следующий, четвёртый, слой шаров в точности повторяет структуру шаров первого слоя. Такая структура называется кубической плотнейшей упаковкой (КПУ) или гранецентрированной кубической упаковкой (ГЦК) и состоит из чередующихся слоёв атомов металлов АВСАВС.
Третья кристаллическая структура (координационное число равно
объёмно-центрированной кубической упаковкой (ОЦУ)
Элементарные ячейки для всех типов кристаллических решёток металлов показаны на рисунке ниже.
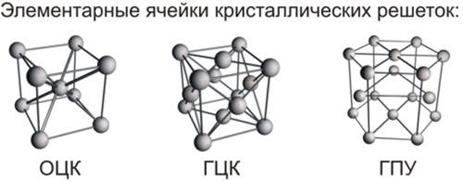
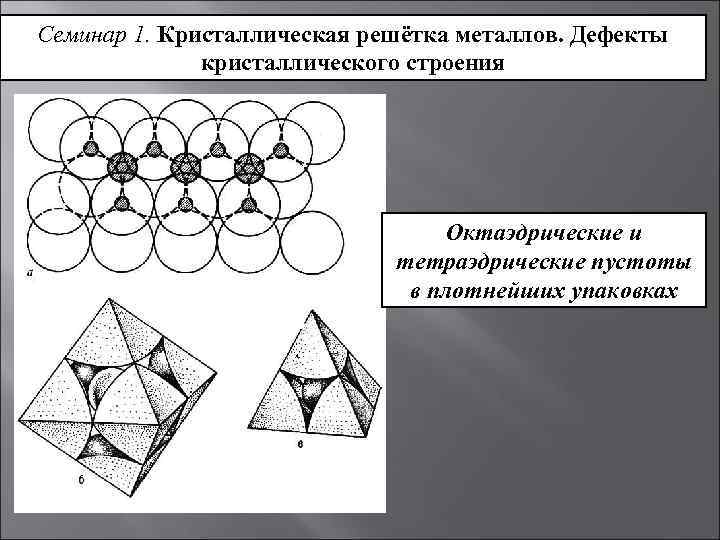
Описанные кристаллические структуры отличаются степенью заполнение пространства: наиболее плотноупакованными (степень заполнения пространства составляет 74%) являются кристаллические решётки ГПУ и КПУ, менее плотноупакована (на 68%) – решётка типа ОЦУ. Пустоты играют важную роль в определении структуры металлических соединений и их сплавов.
Кристаллические решётки некоторых металлов
| Тип решётки | Металл |
| ГПУ | Mg, Zn, Be, Cd, Os, Ru |
| КПУ (ГЦК) | Cu, Ag, Al, Ca, Ni, Au, Pb, Pd, Pt, Co, Sr |
| ОЦУ | Li, Na, K, Rb, Cs, V, Cr, Mo, W, Fe, Ba |
Также важно знать, что ряд металлов в зависимости от температуры может кристаллизоваться в разных типах кристаллических решёток (явление полиморфизма), например белое и серое олово
Наличие порядка в расположении частиц
В аморфном веществе, в отличие от кристаллического, отсутствует какой-либо порядок в расположении частиц. Если же в кристаллическом веществе мысленно соединить прямой два близкоросположенных друг к другу атома, то можно обнаружить, что на этой линии на строго определенных промежутках будут лежать одни и те же частицы:
Таким образом, в случае кристаллических веществах можно говорить о таком понятии, как кристаллическая решетка.
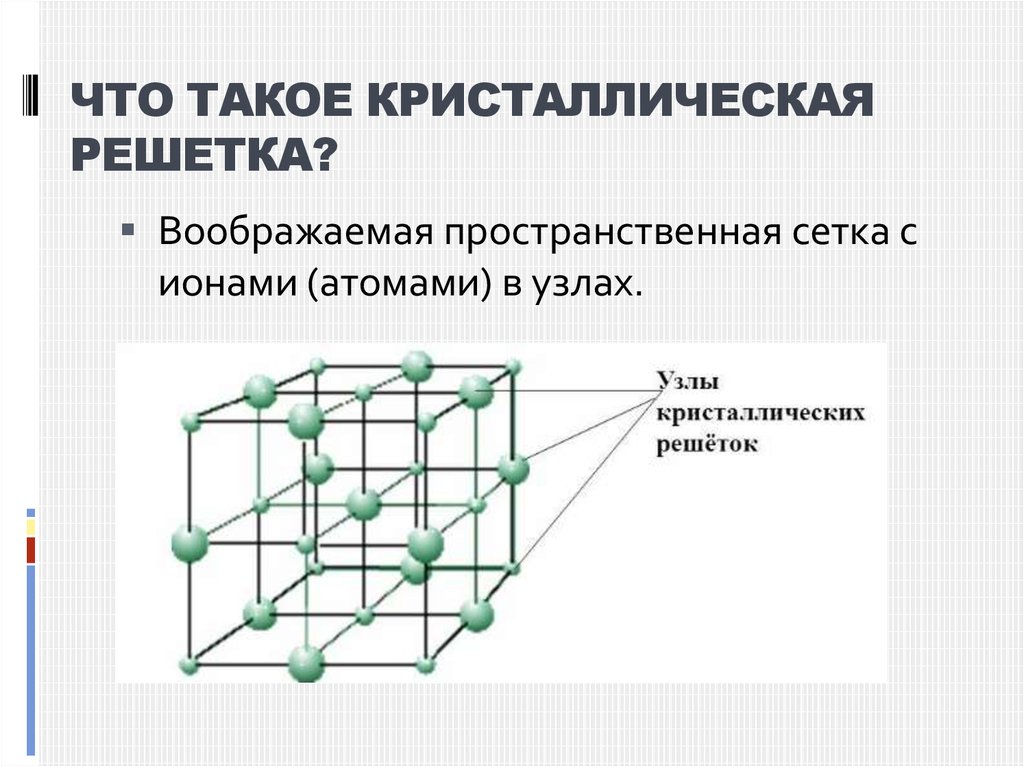
Кристаллической решеткой называют пространственный каркас, соединяющий точки пространства, в которых находятся частицы, образующие кристалл.
Точки пространства, в которых находятся образующие кристалл частицы, называют узлами кристаллической решетки.
В зависимости от того, какие частицы находятся в узлах кристаллической решетки, различают: молекулярную, атомную, ионную и металлическую кристаллические решетки.
В узлах молекулярной кристаллической решетки Кристаллическая решетка льда Кристаллическая решетка льда как пример молекулярной решетки
находятся молекулы, внутри которых атомы связаны прочными ковалентными связями, однако сами молекулы удерживаются друг возле друга слабыми межмолекулярными силами. Вследствие таких слабых межмолекулярных взаимодействий кристаллы с молекулярной решеткой являются непрочными. Такие вещества от веществ с иными типами строения отличаются существенно более низкими температурами плавления и кипения, не проводят электрический ток, могут как растворяться, так и не растворяться в различных растворителях.
Растворы таких соединений могут как проводить, так и не проводить электрический ток в зависимости от класса соединения. К соединениям с молекулярной кристаллической решеткой относятся многие простые вещества — неметаллы (отвержденные H2, O2, Cl2, ромбическая сера S8, белый фосфор P4), а также многие сложные вещества – водородные соединения неметаллов, кислоты, оксиды неметаллов, большинство органических веществ. Следует отметить, что, если вещество находится в газообразном или жидком состоянии, говорить о молекулярной кристаллической решетке неуместно: корректнее использовать термин — молекулярный тип строения.
кристаллическая решетка алмаза Кристаллическая решетка алмаза как пример атомной решетки В узлах атомной кристаллической решетки
находятся атомы. При этом все узлы такой кристаллической решетки «сшиты» между собой посредством прочных ковалентных связей в единый кристалл. Фактически, такой кристалл является одной гигантской молекулой. Вследствие особенностей строения все вещества с атомной кристаллической решеткой являются твердыми, обладают высокими температурами плавления, химически мало активны, не растворимы ни в воде, ни в органических растворителях, а их расплавы не проводят электрический ток. Следует запомнить, что к веществам с атомным типом строения из простых веществ относятся бор B, углерод C (алмаз и графит), кремний Si, из сложных веществ — диоксид кремния SiO2 (кварц), карбид кремния SiC, нитрид бора BN.
У веществ с ионной кристаллической решеткой в узлах решетки находятся ионы, связанные друг с другом посредством ионных связей.
Поскольку ионные связи достаточно прочны, вещества с ионной решеткой обладают сравнительно высокой твердостью и тугоплавкостью. Чаще всего они растворимы в воде, а их растворы, как и расплавы проводят электрический ток. К веществам с ионным типом кристаллической решетки относятся соли металлов и аммония (NH4+), основания, оксиды металлов. Верным признаком ионного строения вещества является наличие в его составе одновременно атомов типичного металла и неметалла.
Кристаллическая решетка хлорида натрия
Кристаллическая решетка хлорида натрия как пример ионной решетки Однако следует отметить, что в веществах с ионным типом строения нередко можно обнаружить, помимо ионных, также ковалентные полярные связи. Это наблюдается в случае сложных ионов, т.е. состоящих из двух или более химических элементов (SO42-, NH4+, PO43- и т.д.). Внутри таких сложных ионов атомы связаны друг с другом ковалентными связями.
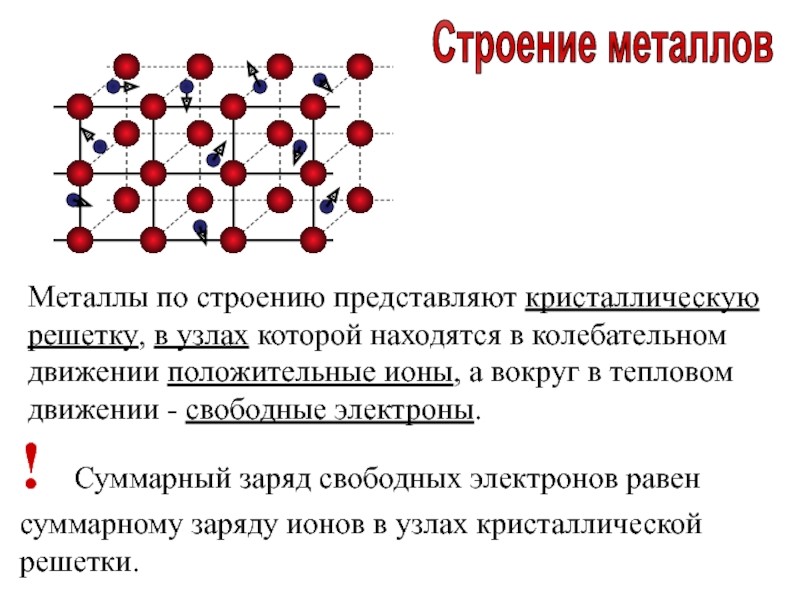
Металлическая кристаллическая решетка
наблюдается в кристаллах свободных металлов, например, натрия Na, железа Fe, магния Mg и т.д. В случае металлической кристаллической решетки, в ее узлах находятся катионы и атомы металлов, между которыми движутся электроны. При этом движущиеся электроны периодически присоединяются к катионам, таким образом нейтрализуя их заряд, а отдельные нейтральные атомы металлов взамен «отпускают» часть своих электронов, превращаясь, в свою очередь, в катионы. Фактически, «свободные» электроны принадлежат не отдельным атомам, а всему кристаллу.
Виды решёток
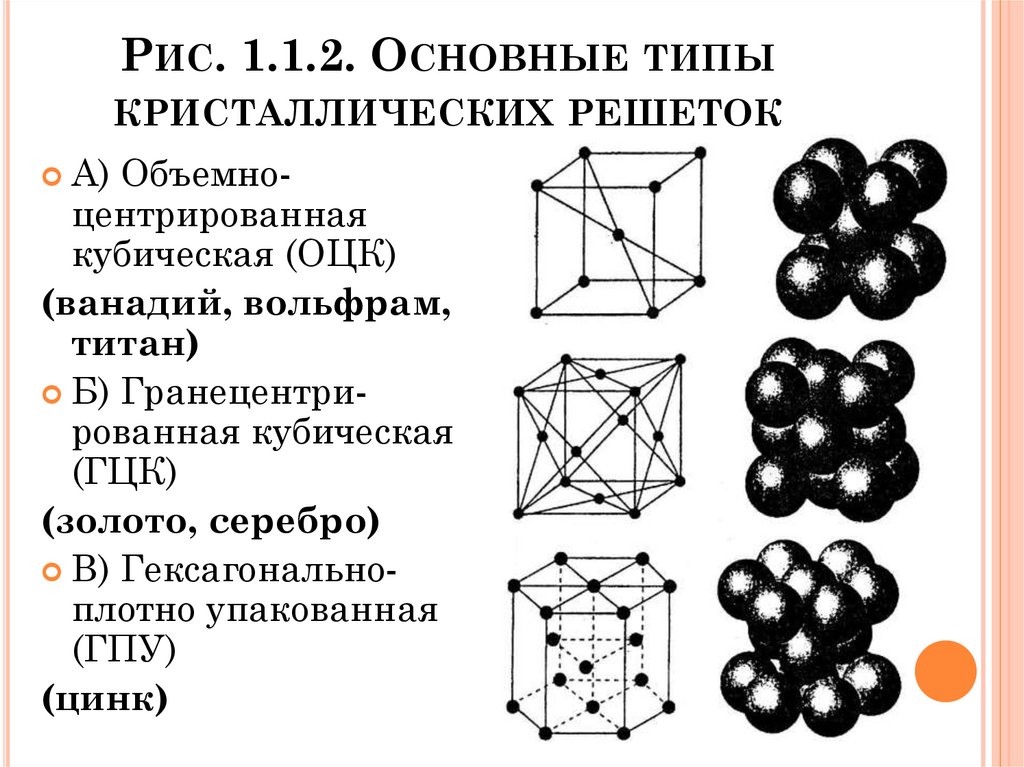
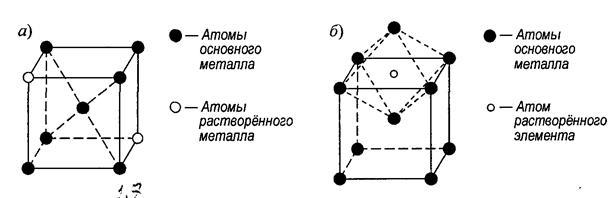
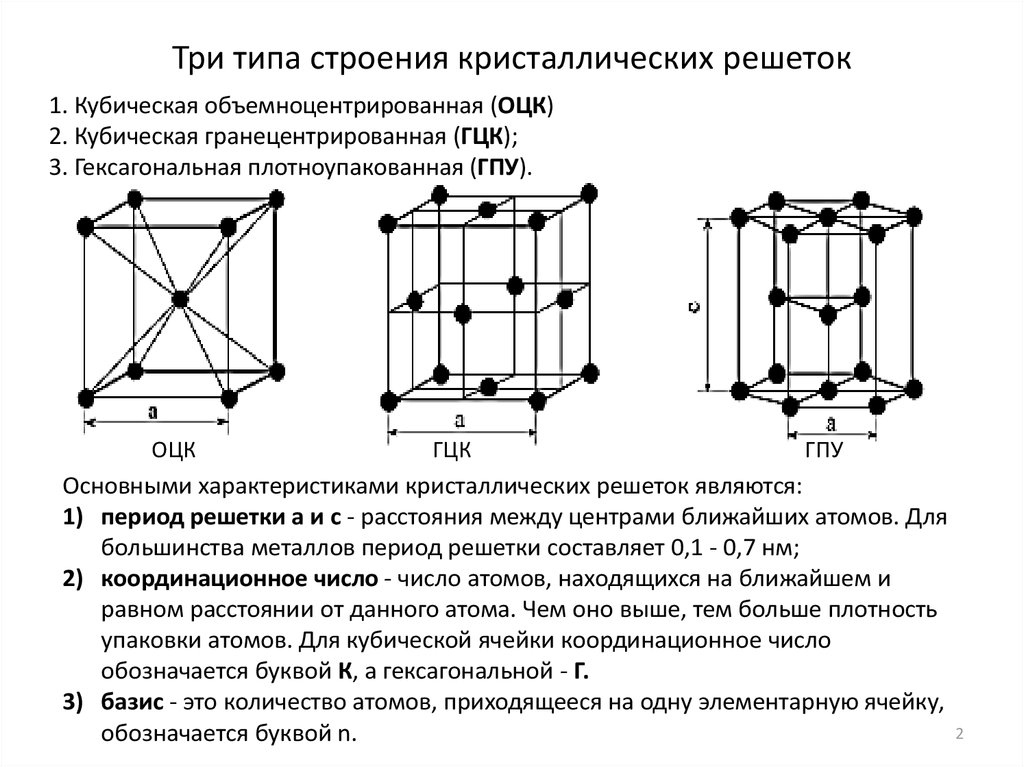
Элементарные кристаллические ячейки могут иметь различную конфигурацию. В связи с этим выделяют три типа кристаллических решёток:
- объемно-центрированная (ОЦК) кубическая – состоит из 9 ионов;
- гранецентрированная (ГЦК) кубическая – включает 14 ионов;
- гексагональная плотноупакованная (ГПУ) – состоит из 17 ионов.
ОЦК представляет собой куб, в узлах которого находится по атому. В центре куба, на пересечении диагоналей располагается девятый ион. Этот тип характерен для железа, молибдена, хрома, вольфрама, ванадия.
Элементарной кристаллической ячейкой типа ГЦК является куб с ионами в узлах и в середине каждой грани – на пересечении диагоналей. Такое строение имеют медь, серебро, алюминий, свинец, никель.
Третий тип имеет вид гексагональной призмы, в узлах которой находится по шесть ионов с каждой стороны. Посередине между шестью узлами располагается по одному иону. В середине призмы между шестиугольными гранями находится равносторонний треугольник, который составляют три иона.
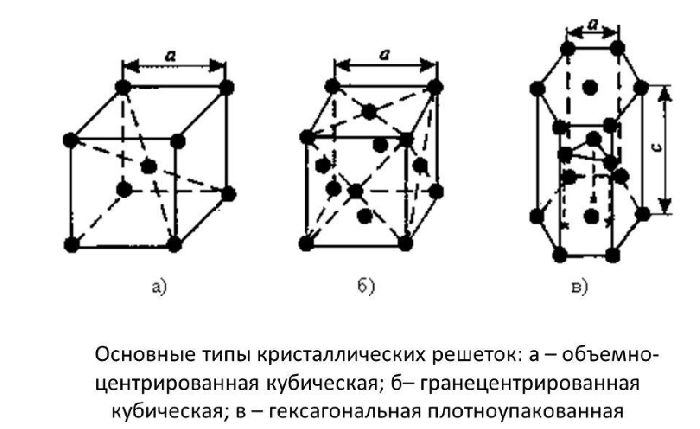
Рис. 2. Типы решёток.
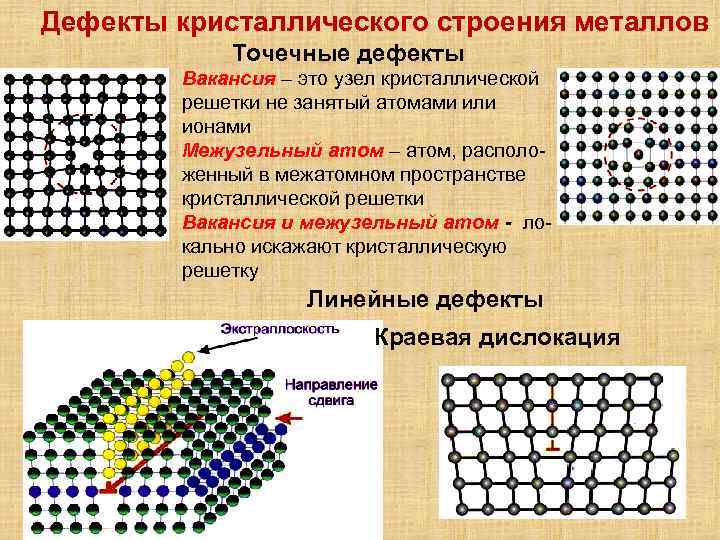
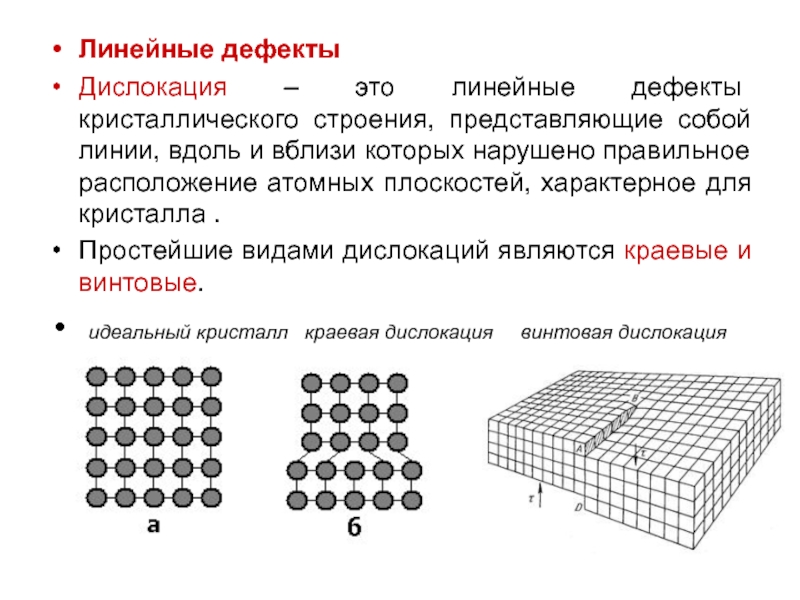
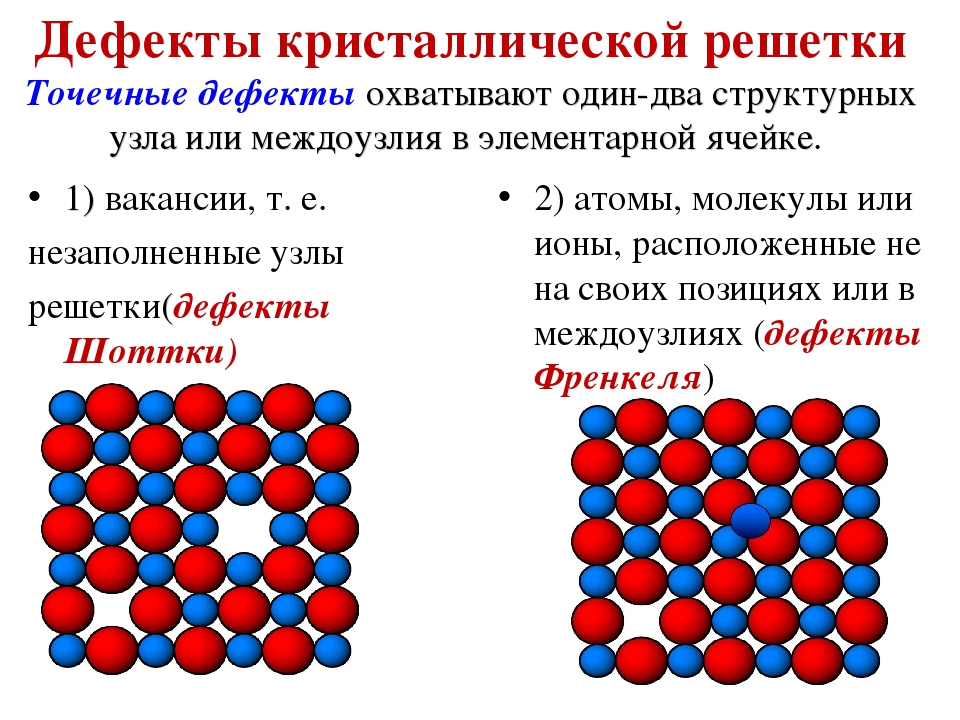
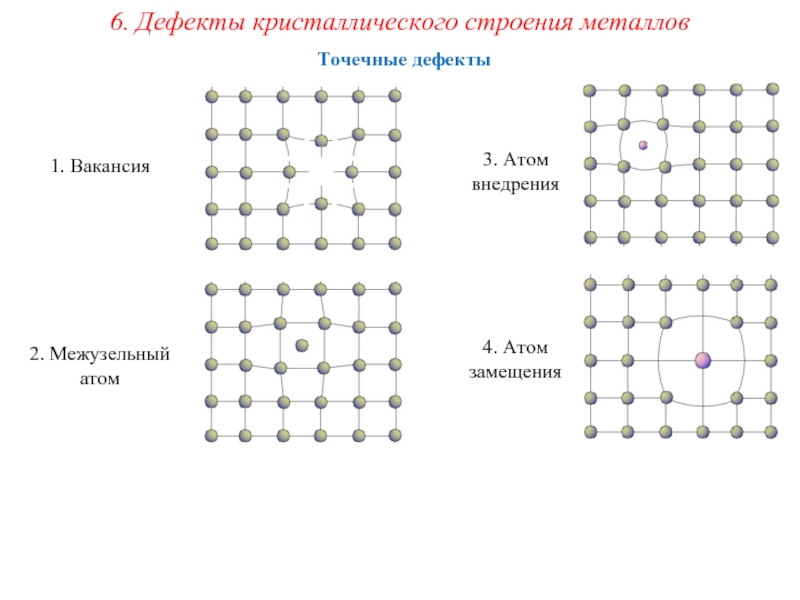
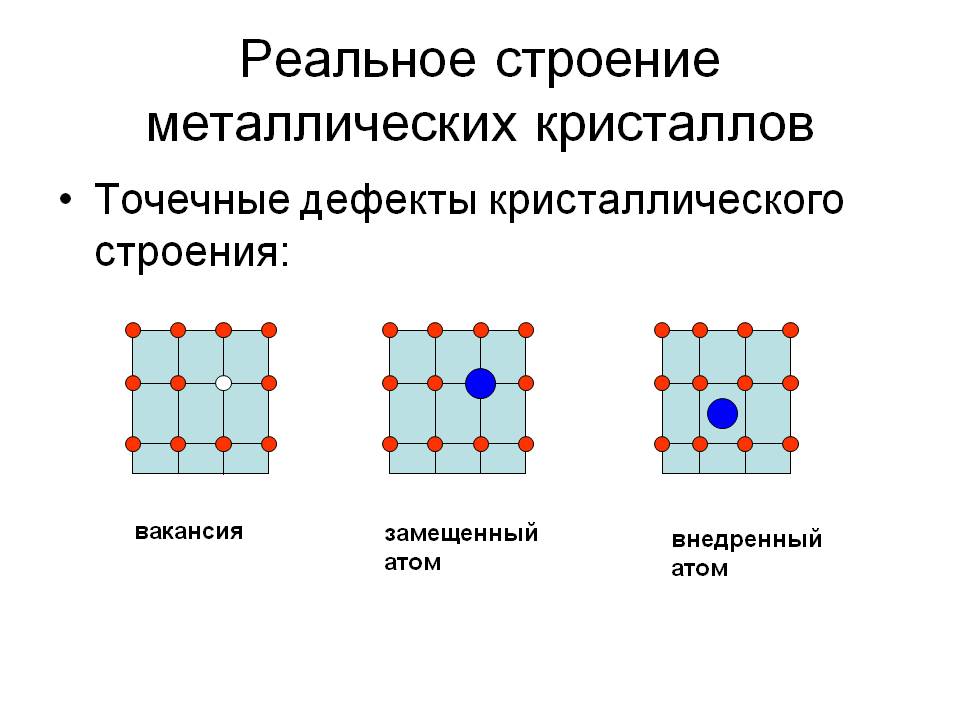
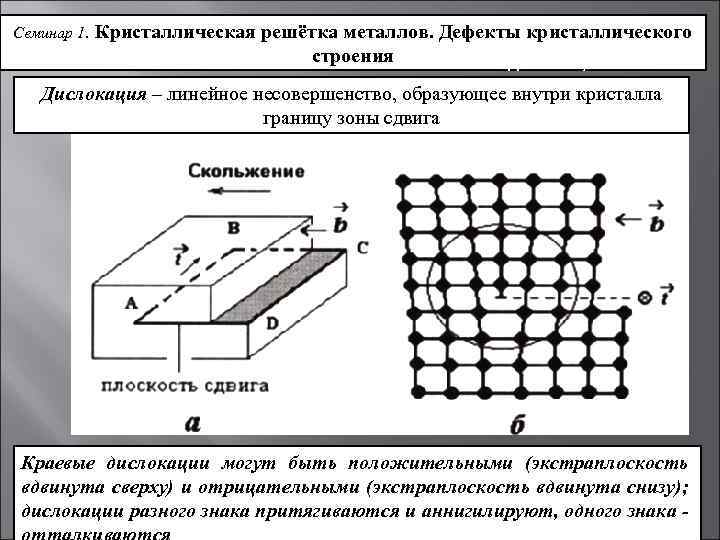
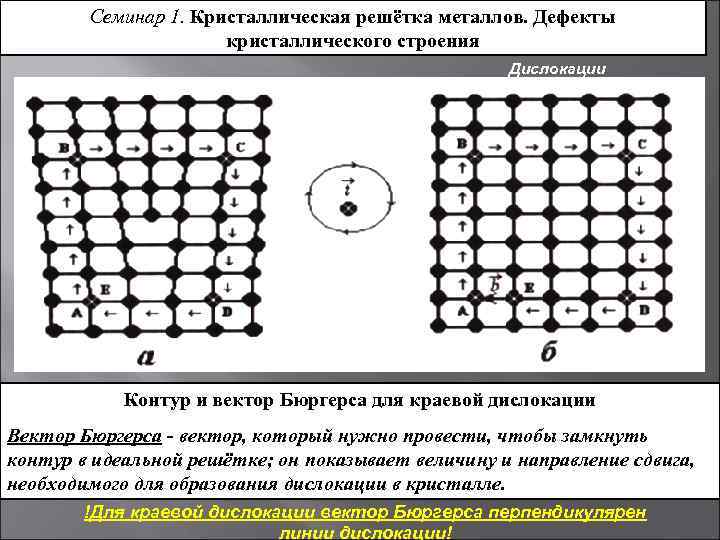
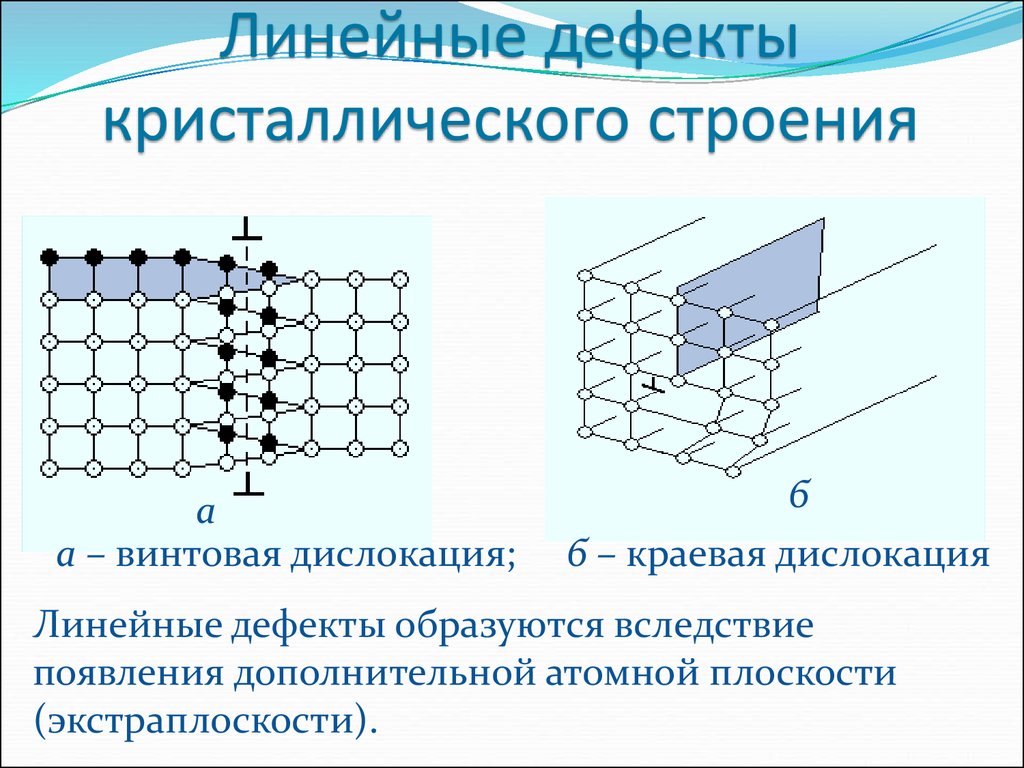
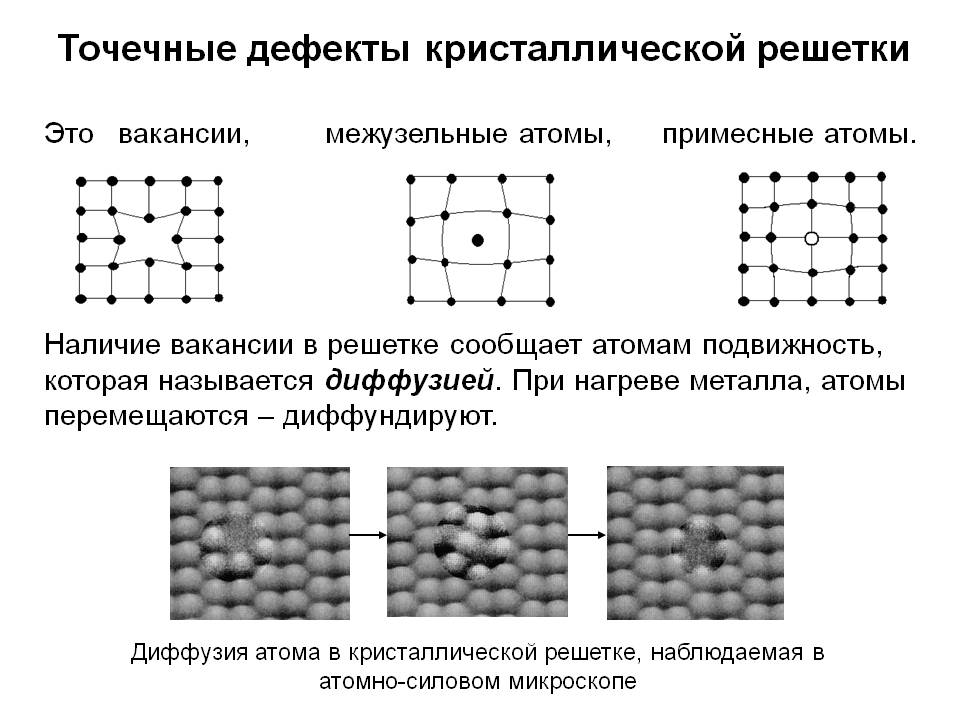
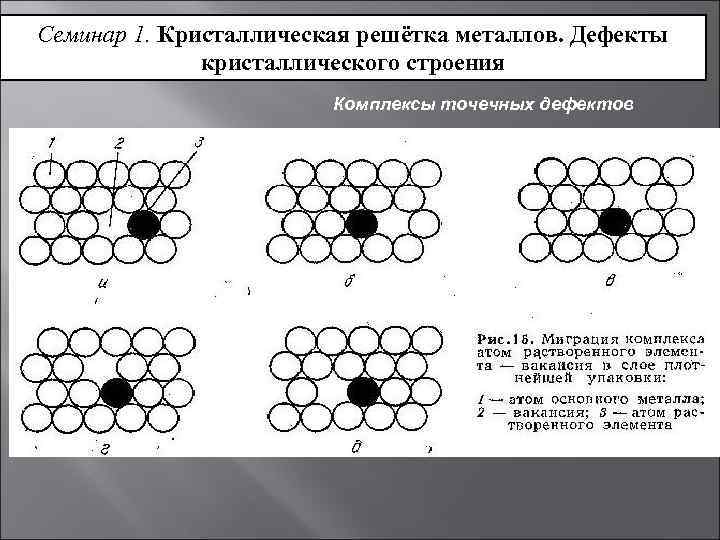
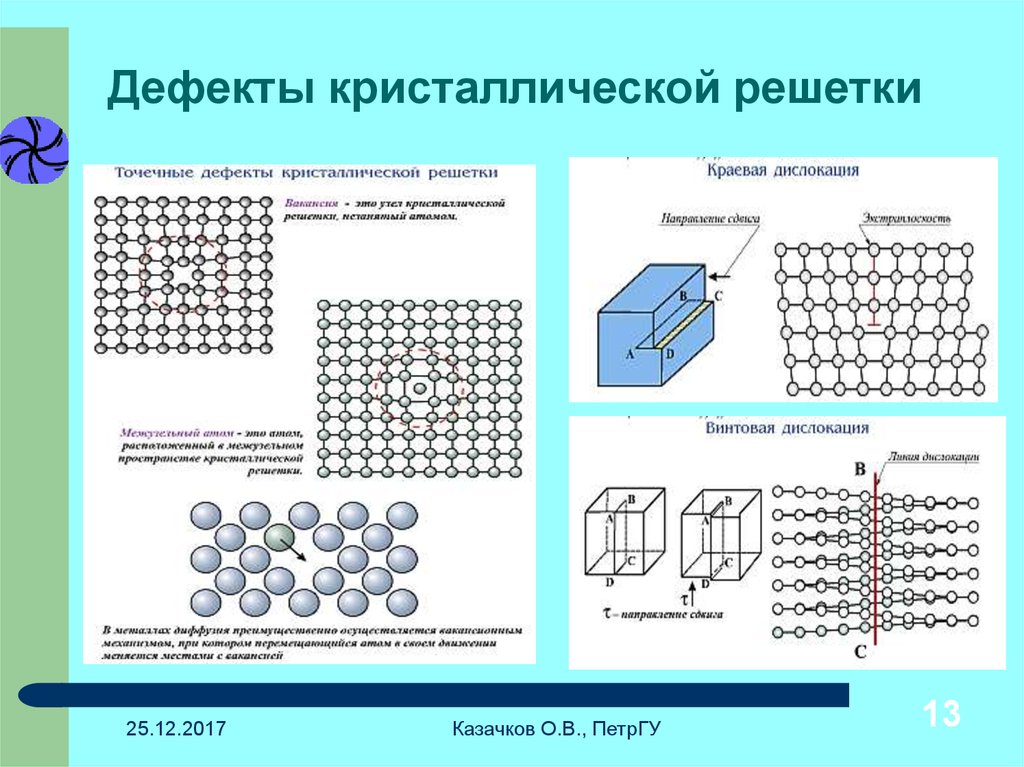
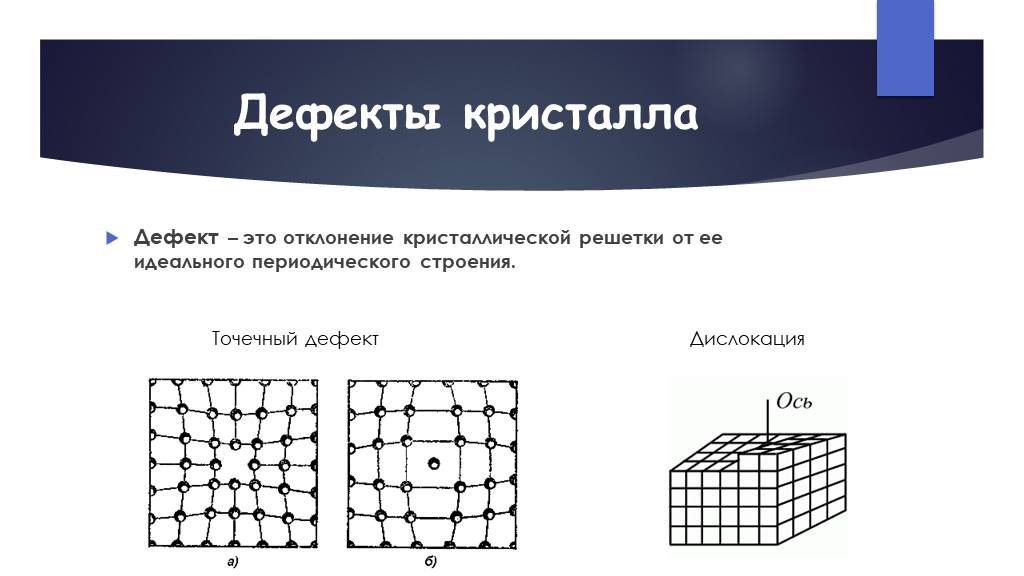
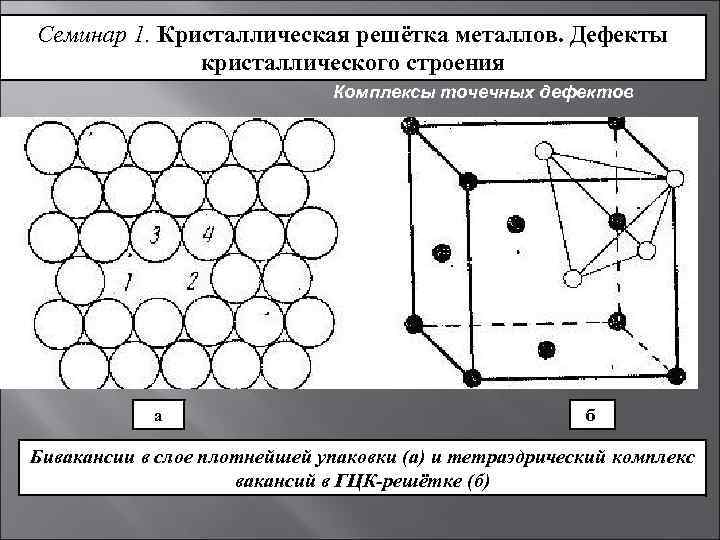
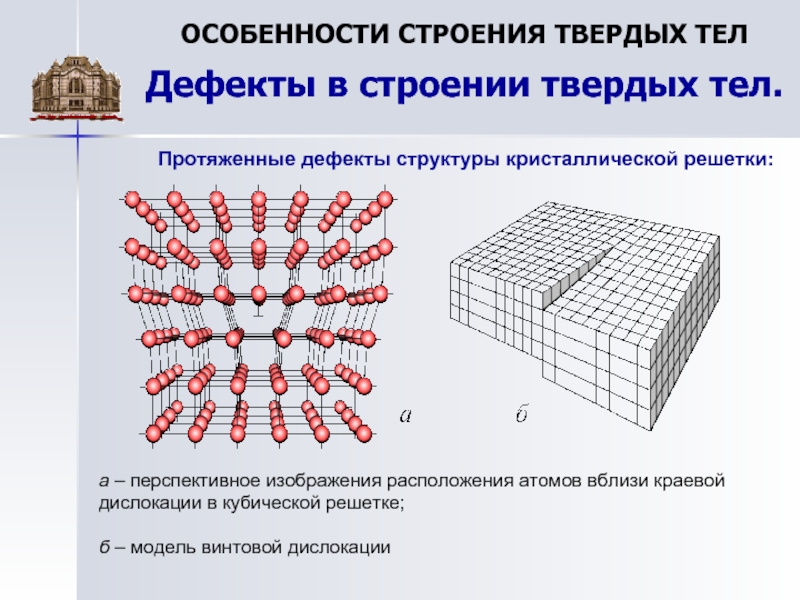
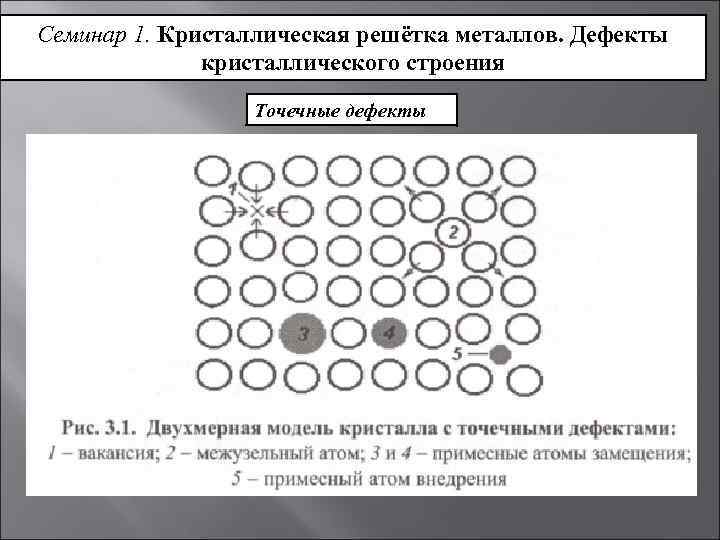
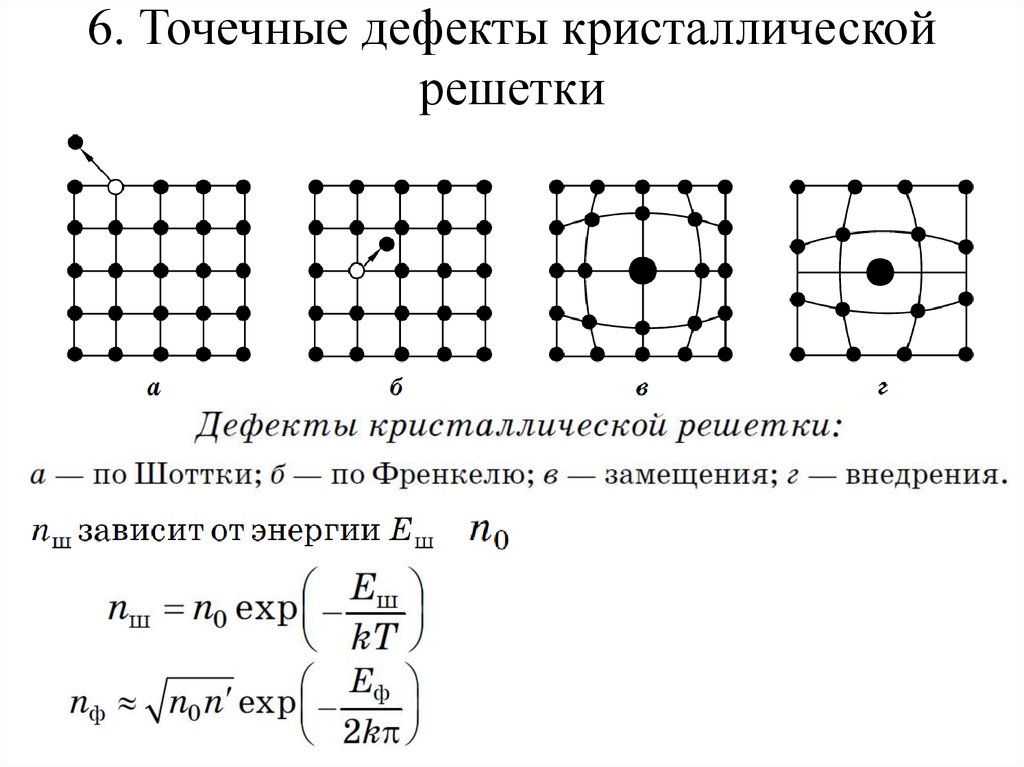
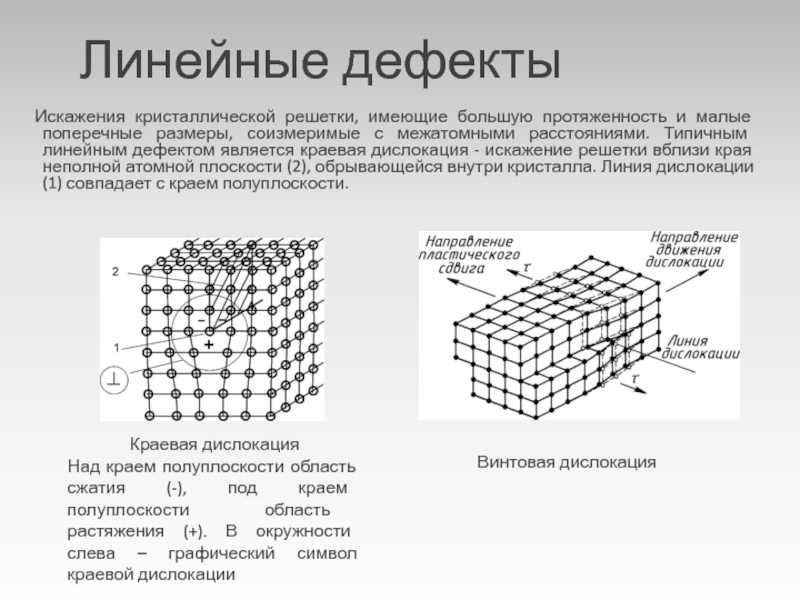
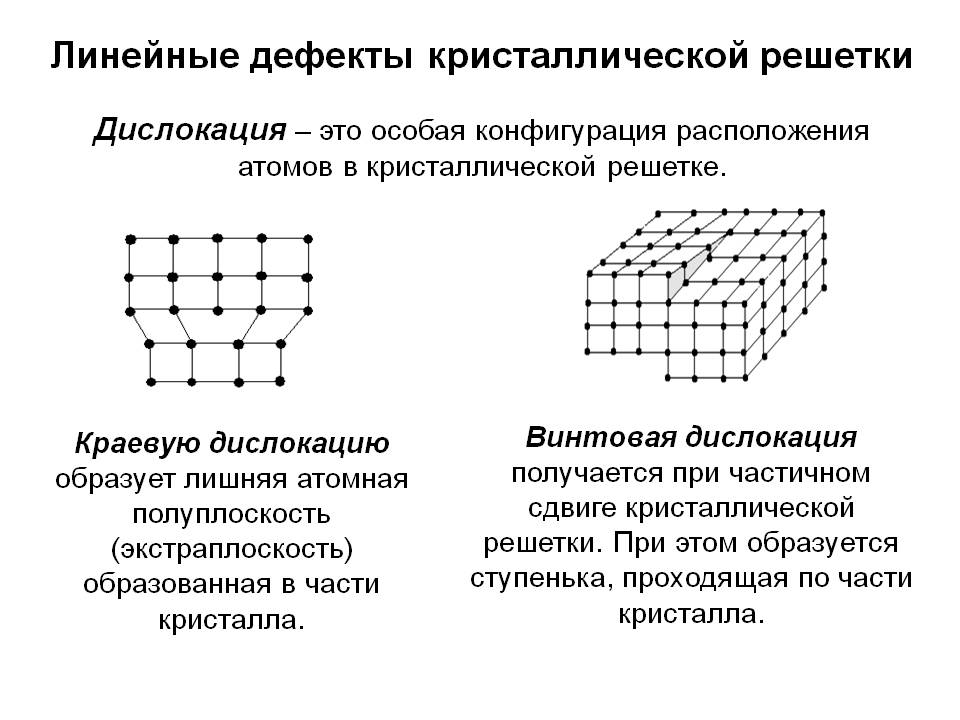
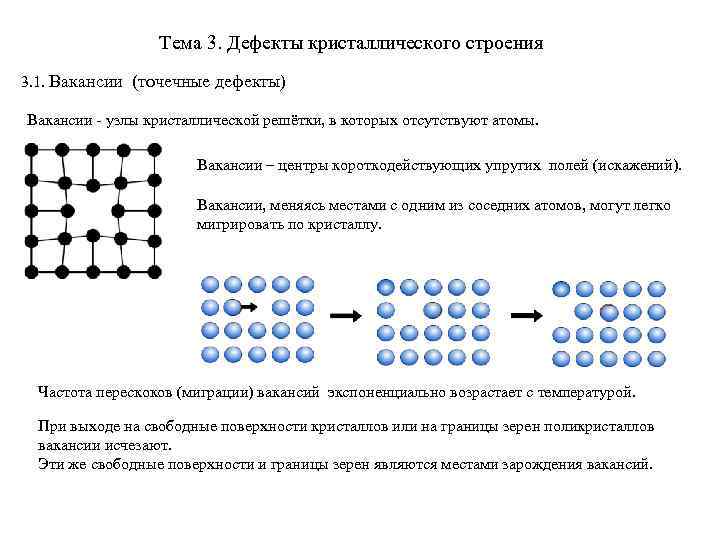
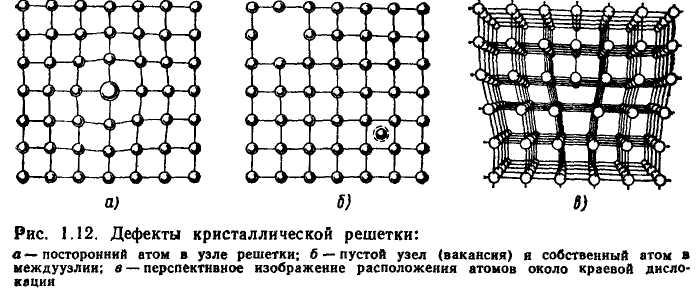
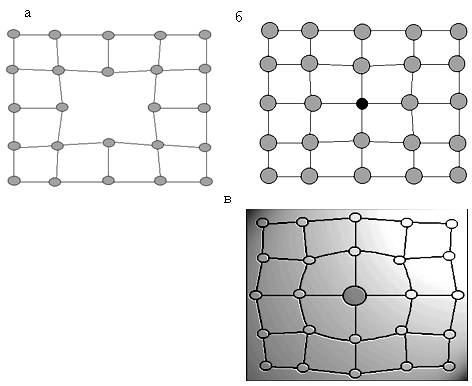
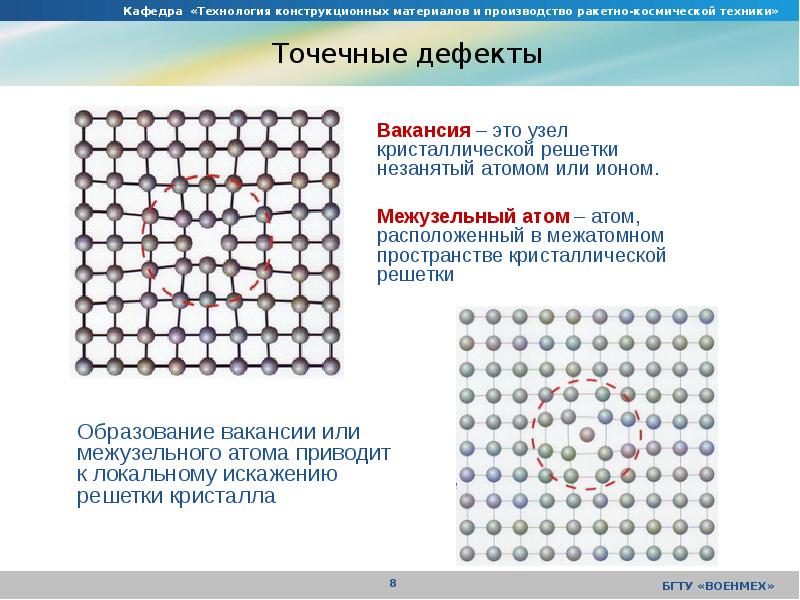
Металл может содержать большое количество дефектов атомного строения. Дефекты влияют на свойства металла.
Молекулярная кристаллическая решетка

Молекулярная кристаллическая решетка – это такая решетка, в узлах которой располагаются молекулы. Удерживают молекулы в кристалле слабые силы межмолекулярного притяжения (силы Ван-дер-Ваальса, водородные связи, или электростатическое притяжение). Соответственно, такую кристаллическую решетку, как правило, довольно легко разрушить. Вещества с молекулярной кристаллической решеткой – легкоплавкие, непрочные. Чем больше сила притяжения между молекулами, тем выше температура плавления вещества. Как правило, температуры плавления веществ с молекулярной кристаллической решеткой не выше 200-300К. Поэтому при нормальных условиях большинство веществ с молекулярной кристаллической решеткой существует в виде газов или жидкостей. Молекулярную кристаллическую решетку, как правило, образуют в твердом виде кислоты, оксиды неметаллов, прочие бинарные соединения неметаллов, простые вещества, образующие устойчивые молекулы (кислород О2, азот N2, вода H2O и др.), органические вещества. Как правило, это вещества с ковалентной полярной (реже неполярной) связью. Т.к. электроны задействованы в химических связях, вещества с молекулярной кристаллической решеткой – диэлектрики, плохо проводят тепло.

Связь между частицами в молекулярных кристаллах: межмолекулярные водородные связи, электростатические или межмолекулярные силы притяжения.
В узлах кристалла с молекулярной кристаллической структурой расположены молекулы.
Фазовое состояние молекулярных кристаллов при нормальных условиях: газы, жидкости и твердые вещества.
Вещества, образующие в твердом состоянии молекулярные кристаллы:
- Простые вещества-неметаллы, образующие маленькие прочные молекулы (O2, N2, H2, S8 и др.);
- Сложные вещества (соединения неметаллов) с ковалентными полярными связями (кроме оксидов кремния и бора, соединений кремния и углерода) — вода H2O, оксид серы SO3 и др.
- Одноатомные инертные газы (гелий, неон, аргон, криптон и др.);
- Большинство органических веществ, в которых нет ионных связей — метан CH4, бензол С6Н6 и др.
Физические свойства веществ с молекулярной кристаллической решеткой:
— легкоплавкость (низкая температура плавления):
— высокая сжимаемость;
— молекулярные кристаллы в твердом виде, а также в растворах и расплавах не проводят ток;
— фазовое состояние при нормальных условиях – газы, жидкости, твердые вещества;
— высокая летучесть;
— малая твердость.
Металлическая связь
Изучая атомно-кристаллическое строение металлов, следует сказать несколько слов об особенностях химической связи между рассматриваемыми элементами. Поскольку электроотрицательность металлов низкая, то, объединяясь в кристаллическую решетку, каждый атом отдает один или несколько валентных электронов. Эти электроны слабо связаны с ядром, поэтому они легко от него отрываются уже при комнатных температурах.
Совокупность валентных электронов, которые свободно движутся в пространстве между ионными остовами в кристаллической решетке металлов, называется электронным газом. Благодаря ему кусок металла легко проводит тепло и электричество.
Электрическое поле положительно заряженных ионных остовов компенсируется отрицательным полем “размазанного” по объему металла электронного газа. Такая связь называется металлической. Она кардинальным образом отличается от других типов химической связи. Например, в ковалентной атомы не отдают электроны в межатомное пространство, они становятся общими только для двух атомов. Наоборот, в ионной связи один атом полностью лишает второго валентных электронов, присоединяя их к себе, и приобретая отрицательный заряд.
История появления меди
О том, какое великое значение имел этот химический элемент в истории человечества и планеты, можно догадаться уже по названиям исторических эпох. После каменного века наступил медный, а за ним — бронзовый, также имеющий прямое отношение к этому элементу.
Медь является одним из семи металлов, которые стали известны человечеству еще в древности. Если верить историческим данным, знакомство древних людей с этим металлом произошло примерно девять тысяч лет назад.
Древнейшие изделия из этого материала были обнаружены на территории современной Турции. Археологические раскопки, проведенные на месте крупного поселения времен неолита под названием Чаталхеюк, позволили отыскать небольшие медные шарики-бусины, а также медные пластины, которыми древние люди украшали свой наряд.
Найденные вещицы были датированы стыком восьмого и седьмого тысячелетий до нашей эры. Помимо самих изделий, на месте раскопок был обнаружен шлак, что говорит о производившихся выплавках металла из руды.
Получение меди из руды было относительно доступно. Поэтому несмотря на свою высокую температуру плавления, этот металл в числе первых был быстро и широко освоен человечеством.
Способы добычи
В природных условиях этот химический элемент существует в двух формах:
- соединения;
- самородки.
Любопытным фактом является следующее: медные самородки в природе попадаются гораздо более часто, чем золотые, серебряные и железные.
Природные соединения меди — это:
- оксиды;
- углекислые и сернистые комплексы;
- гидрокарбонаты;
- сульфидные руды.
Рудами, имеющими наибольшее распространение, являются медный блеск и медный колчедан. Меди в этих рудах содержится всего один-два процента. Первичная медь добывается двумя основными способами:
- гидрометаллургическим;
- пирометаллургическим.
Доля первого способа составляет десять процентов. Оставшиеся девяносто относятся ко второму методу.
Пирометаллический способ включает в себя комплекс процессов. Сначала медные руды обогащаются и обжигаются. Затем сырье плавится на штейн, после чего продувается в конвертере. Таким образом получается черновая медь. Превращение ее в чистую осуществляется путем рафинирования — сначала огневого, затем электролитического. Это последняя стадия. По ее окончании чистота полученного металла составляет практически сто процентов.
Процесс получения меди гидрометаллургическим способом делится на два этапа.
- Вначале сырье выщелачивается при помощи слабого раствора серной кислоты.
- На заключительном этапе металл выделяется непосредственно из упомянутого в первом пункте раствора.
Данный метод используется при переработке только бедных руд, так как, в отличие от предыдущего способа, при его проведении невозможно попутно извлечь драгоценные металлы. Именно поэтому приходящийся на этот способ процент так невелик по сравнению с другим методом.
Немного о названии
Химический элемент Cuprum, обозначаемый символом Cu, получил свое название в честь небезызвестного острова Кипр. Именно там в далеком третьем веке до нашей эры были обнаружены крупные месторождения медной руды. Местными мастерами, трудившимися на этих рудниках, производилась выплавка данного металла.
Виды кристаллических решеток металлов
В огромном ряду материалов, с незапамятных времен известных человеку и широко используемых им в своей жизни и деятельности, металлы всегда занимали особое место.
Подтверждение этому: и в названиях эпох (золотой, серебряный, бронзовый, железный века), на которые греки делили историю человечества: и в археологических находках металлических изделий (кованые медные украшения, сельскохозяйственные орудия); и в повсеместном использовании металлов и сплавов в современной технике. Причина этого — в особых свойствах металлов, выгодно отличающих их от других материалов и делающих во многих случаях незаменимыми.
Материаловедение. Металловедение.
Металлы – один из классов конструкционных материалов, характеризующийся определенным набором свойств:
- «металлический блеск» (хорошая отражательная способность);
- пластичность;
- высокая теплопроводность;
- высокая электропроводность.
Строение металлов. Атомно-кристаллическое строение металлов
Данные свойства обусловлены особенностями строения металлов.
Согласно теории металлического состояния, металл представляет собой вещество, состоящее из положительных ядер, вокруг которых по орбиталям вращаются электроны.
На последнем уровне число электронов невелико и они слабо связаны с ядром. Эти электроны имеют возможность перемещаться по всему объему металла, т.е. принадлежать целой совокупности атомов.
Дефекты кристаллического строения. Точечные дефекты.Аллотропия. Полиморфные превращения. Магнитные превращения.
Таким образом, пластичность, теплопроводность и электропроводность обеспечиваются наличием «электронного газа».
Кристаллическая решетка металлов
Все металлы, затвердевающие в нормальных условиях, представляют собой кристаллические вещества, то есть укладка атомов в них характеризуется определенным порядком – периодичностью, как по различным направлениям, так и по различным плоскостям. Этот порядок определяется понятием кристаллическая решетка. Другими словами, кристаллическая решетка это воображаемая пространственная решетка, в узлах которой располагаются частицы, образующие твердое тело.
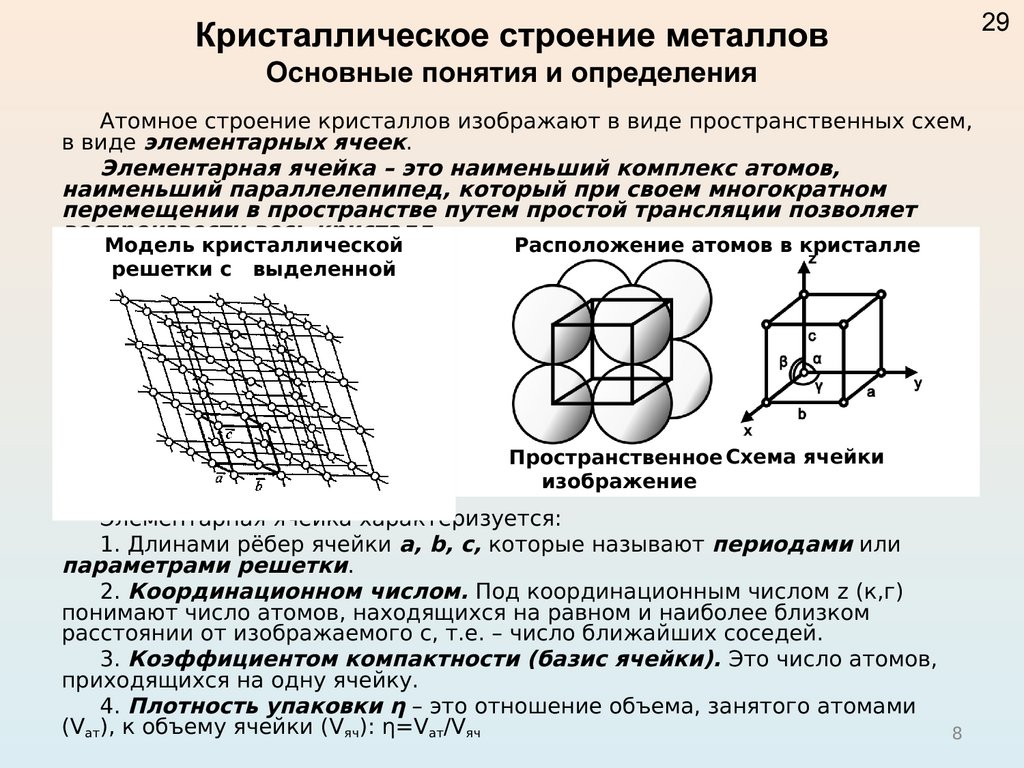
Элементарная ячейка – элемент объема из минимального числа атомов, многократным переносом которого в пространстве можно построить весь кристалл. Элементарная ячейка характеризует особенности строения кристалла. Основными параметрами кристалла являются:
- размеры ребер элементарной ячейки. a, b, c – периоды решетки – расстояния между центрами ближайших атомов (в одном направлении выдерживаются строго определенными);
- углы между осями (α, β, χ);
- координационное число (К) указывает на число атомов, расположенных на ближайшем одинаковом расстоянии от любого атома в решетке;
- базис решетки количество атомов, приходящихся на одну элементарную ячейку решетки;
- плотность упаковки атомов в кристаллической решетке – объем, занятый атомами, которые условно рассматриваются как жесткие шары. Ее определяют как отношение объема, занятого атомами к объему ячейки (для объемно-центрированной кубической решетки – 0,68, для гранецентрированной кубической решетки – 0,74).
Схема кристаллической решетки
Рис. 1
Классификация возможных видов кристаллических решеток была проведена французским ученым О. Браве, соответственно они получили название «решетки Браве». Всего для кристаллических тел существует четырнадцать видов решеток, разбитых на четыре типа:
- примитивный – узлы решетки совпадают с вершинами элементарных ячеек;
- базоцентрированный – атомы занимают вершины ячеек и два места в противоположных гранях;
- объемно-центрированный – атомы занимают вершины ячеек и ее центр;
- гранецентрированный – атомы занимают вершины ячейки и центры всех шести граней.