использовать
Сверхпроводящий резонатор из ниобия высокой чистоты для лазера на свободных электронах в DESY .
Ниобий используется в качестве легирующей добавки для нержавеющих сталей, специальных нержавеющих сталей (например, труб для производства соляной кислоты) и цветных сплавов, поскольку легированные ниобием материалы характеризуются повышенной механической прочностью. Даже в концентрациях от 0,01 до 0,1 процента по массе ниобий в сочетании с термомеханической прокаткой может значительно повысить прочность и ударную вязкость стали. Первые попытки использовать ниобий в качестве легирующего элемента (замены вольфрама ) были предприняты в США в 1925 году. Обработанные таким образом стали часто используются при строительстве трубопроводов. В качестве сильного карбидообразователя ниобий также добавляют в сварочные материалы для связывания углерода.
Монета Австрия штамп 25 евро биметаллических с сердцевиной ниобия.
Другое использование:
- Применение в ядерной технологии из – за низкий сечение захвата для тепловых нейтронов .
- Производство сварочных электродов, стабилизированных ниобием, в качестве присадочных материалов для нержавеющих сталей , специальных нержавеющих сталей и сплавов на никелевой основе .
- Из-за своего голубоватого цвета он используется для пирсинга ювелирных изделий и изготовления ювелирных украшений.
- В алюминиевых сплавах он используется для производства легких, но жестких компонентов и транспортных средств, таких как обода велосипедов.
- В случае монет с ниобием (биметаллические монеты) цвет ядра ниобия может сильно различаться из-за физических процессов (например, для монет за 25 евро из Австрии).
Черная часть сопла ракеты изготовлена из ниобий-титанового сплава.
- Значительные количества феррониобов и ниобов никеля используются в металлургической промышленности для производства жаропрочных сплавов (никель, кобальт и сплавы на основе железа). Из него изготавливаются статические детали для стационарных и летающих газовых турбин, детали ракет и жаропрочные детали для печного строительства.
- Ниобий используется в качестве анодного материала в ниобиевых электролитических конденсаторах . Оксид ниобия, оксид ниобия (V), обладает высокой диэлектрической прочностью. Он наносится на поверхность ниобиевого анода в так называемом процессе формования и служит диэлектриком в этом конденсаторе. Ниобиевые электролитические конденсаторы конкурируют с более популярными танталовыми электролитическими конденсаторами .
- Стеклянные колбы галогенных ламп снаружи с буквой z. B. niobium, часть теплового излучения вольфрамовой нити отражается обратно внутрь. В результате может быть достигнута более высокая рабочая температура и, следовательно, большая световая отдача при меньшем потреблении энергии.
- В качестве катализатора (например, при производстве соляной кислоты, при синтезе биодизельного топлива и при производстве спиртов из бутадиена).
- Как ниобат калия (химическое соединение калия, ниобия и кислорода), который используется в качестве монокристалла в лазерной технологии и для нелинейных оптических систем.
- Использование в качестве электродного материала для
- Сверхпроводимость : При температурах ниже 9,5 К, чистый ниобий является типом II , сверхпроводник сплавы ниобия (с N, O, Sn, Alge, Ge) принадлежит к. Типу II веществ в дополнении к чистым элементам ниобию, ванадий и технеций -Superconductors является : Температура перехода этих сплавов составляет от 18,05 К ( ниобий-олово Nb 3 Sn) до 23,2 К ( ниобий-германий Nb 3 Ge). Сверхпроводящие объемные резонаторы из ниобия используются в ускорителях частиц (включая XFEL и в DESY в Гамбурге). – Для создания сильных магнитных полей до 20 Тесла используются сверхпроводящие магнитные катушки с проводами из ниобий-олова или ниобий-титана, например Б. в термоядерном реакторе ИТЭР 600 т ниобий-олово и 250 т ниобий-титан. Катушки сверхпроводящего магнита LHC также сделаны из сплавов ниобия.
- Благодаря своей биосовместимости ниобий используется для поверхностного покрытия имплантатов.
- Чтобы противодействовать межкристаллитной коррозии , ниобий используется в качестве легирующего элемента в хромистых сталях. Для этого он должен присутствовать как минимум в двенадцатикратной концентрации углерода. Ниобий образует карбиды быстрее, чем хром. Следовательно, не происходит образования богатых хромом карбидов, что означало бы, что обедненные хромом области развиваются в другом месте структуры.
Производство
Производители ниобия в 2006-2015 гг.
После отделения от других минералов получают смешанные оксиды тантала Ta 2 O 5 и ниобия Nb 2 O 5 . Первым этапом обработки является реакция оксидов с плавиковой кислотой :
- Ta 2 O 5 + 14 HF → 2 H 2 [TaF 7 ] + 5 H 2 O
- Nb 2 O 5 + 10 HF → 2 H 2 [NbOF 5 ] + 3 H 2 O
Первое разделение в промышленном масштабе, разработанное де Мариньяком , использует различные растворимости комплексных фторидов ниобия и тантала , моногидрата оксипентафторониобата калия (K 2 [NbOF 5 ] · H 2 O) и гептафтортанталата калия (K 2 [TaF 7 ]) в вода. В более новых процессах используется жидкостная экстракция фторидов из водного раствора органическими растворителями, такими как циклогексанон . Комплексные фториды ниобия и тантала экстрагируют отдельно из органического растворителя водой и либо осаждают добавлением фторида калия с получением комплекса фторида калия, либо осаждают аммиаком в качестве пентоксида:
- H 2 [NbOF 5 ] + 2 KF → K 2 [NbOF 5 ] ↓ + 2 HF
С последующим:
- 2 H 2 [NbOF 5 ] + 10 NH 4 OH → Nb 2 O 5 ↓ + 10 NH 4 F + 7 H 2 O
Для восстановления до металлического ниобия используется несколько методов . Электролизе расплавленной смеси K 2 [NbOF 5 ] и хлорида натрия является одним; другой – восстановление фторида натрием . С помощью этого метода можно получить ниобий относительно высокой чистоты. При крупномасштабном производстве Nb 2 O 5 восстанавливают водородом или углеродом. В алюмотермической реакции смесь оксида железа и оксида ниобия реагирует с алюминием :
- 3 Nb 2 O 5 + Fe 2 O 3 + 12 Al → 6 Nb + 2 Fe + 6 Al 2 O 3
Для усиления реакции добавляют небольшие количества окислителей, таких как нитрат натрия . В результате получается оксид алюминия и феррониобий , сплав железа и ниобия, используемый в производстве стали. Феррониобий содержит от 60 до 70% ниобия. Без оксида железа для производства ниобия используется алюминотермический процесс. Для получения класса сверхпроводящих сплавов необходима дополнительная очистка . Электронно-лучевая плавка в вакууме – метод, используемый двумя основными распространителями ниобия.
По состоянию на 2013 год CBMM из Бразилии контролировал 85 процентов мирового производства ниобия. По оценкам Геологической службы США, производство увеличилось с 38 700 тонн в 2005 году до 44 500 тонн в 2006 году. Мировые ресурсы оцениваются в 4 400 000 тонн. За десятилетний период с 1995 по 2005 год производство увеличилось более чем вдвое, начиная с 17 800 тонн в 1995 году. В период с 2009 по 2011 год производство было стабильным на уровне 63 000 тонн в год с небольшим снижением в 2012 году до 50 000 тонн в год. .
| Страна | 2000 г. | 2001 г. | 2002 г. | 2003 г. | 2004 г. | 2005 г. | 2006 г. | 2007 г. | 2008 г. | 2009 г. | 2010 г. | 2011 г. | 2012 г. | 2013 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Австралия | 160 | 230 | 290 | 230 | 200 | 200 | 200 | ? | ? | ? | ? | ? | ? | ? |
| Бразилия | 30 000 | 22 000 | 26 000 | 29 000 | 29 900 | 35 000 | 40 000 | 57 300 | 58 000 | 58 000 | 58 000 | 58 000 | 45 000 | 53 100 |
| Канада | 2290 | 3 200 | 3 410 | 3 280 | 3 400 | 3 310 | 4 167 | 3020 | 4380 | 4330 | 4 420 | 4 630 | 4,710 | 5 260 |
| Конго ДР | ? | 50 | 50 | 13 | 52 | 25 | ? | ? | ? | ? | ? | ? | ? | ? |
| Мозамбик | ? | ? | 5 | 34 | 130 | 34 | 29 | ? | ? | ? | ? | ? | ? | ? |
| Нигерия | 35 год | 30 | 30 | 190 | 170 | 40 | 35 год | ? | ? | ? | ? | ? | ? | ? |
| Руанда | 28 год | 120 | 76 | 22 | 63 | 63 | 80 | ? | ? | ? | ? | ? | ? | ? |
| Мир | 32 600 | 25 600 | 29 900 | 32 800 | 34 000 | 38 700 | 44 500 | 60 400 | 62 900 | 62 900 | 62 900 | 63 000 | 50 100 | 59 400 |
Меньшие количества находятся на месторождении Каньяка в Малави ( рудник Каньяка ).
Производство ниобия
Несмотря на то, что запасы Nb-содержащих руд превосходят аналоги для тантала, первые характеризуются очень скудным содержанием элемента. Как правило, концентраты содержат пятиокись ниобия – Nb2O5, процентное вхождение которое определяется типом руды:
пирохлоровая – до 37%;
лопаритовая – 8%;
колумбитовая – от 30 до 60%.
Обычно, руда ниобия проходит цикл термического восстановления с участием алюминия или кремния. Результат процесса – соединения феррониобий и ферротанталониобий. Металлический ниобий добывают из аналогичного сырья, но сама технология более сложная и состоит из трех стадий:
- Добыча руды, его содержащей, переработка до состояния концентратов их вскрытие.
- Получение химических соединений Nb и Та с привлечением методов порошковой металлургии.
- Рафинирование позволяет получать металлический ниобий высокой пробы.

Так выглядит феррониобий
На сегодня, наиболее развиты такие методики получения Nb, как алюмино-, натрие- и карботермическая. Различными оказываются и прекурсоры для высокотемпературного восстановления ниобия. При натриетермическом способе – это K2NbF7, тогда как в алюминотермической методике используется пятиокись ниобия. Карботермическая технология подразумевает смешивание оксида Nb с сажей в высокотемпературной водородной среде, чтобы получить карбид ниобия. На следующем этапе, водородная среда заменяется вакуумом, и при тех же температурах, смешав карбид ниобия с его оксидом, получают сам металл.

Фольга из ниобия
Бестигельная электроннолучевая зонная плавка дает возможность вести производство монокристаллов Nb. Методами порошковой металлургии, пользуются для получения сначала сплавов, а после и чистого металла ниобий. Поэтому ничего удивительного, что «куплю ниобий» – частое содержание объявлений, публикуемых на страницах интернета. Ведь в таких ситуациях, вполне можно использовать вторичное сырье, а не руду или концентрат из нее.
Среди форм выпускаемого металла распространен ниобий в слитках. Они предназначены на изготовление сплавов на базе металла и прочих полуфабрикатов. Альтернативно выпускается штабик ниобия, классифицируемый соответственно чистоте химического состава. Наименьшее содержание примесей соответствует марке НБШ-00. Штабик ниобия НБШ-0 отличается повышенным вхождением железа, кремния тантала и титана. Наиболее легированная марка штабика ниобия – НБШ-1.
Альтернативная форма выпуска – прокат ниобия. В частности, большинство организаций предпочитает покупать листовой металл, пруток, проволоку. Еще одна разновидность проката ниобий фольга.
Примечания
- Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047—1078. — DOI:10.1351/PAC-REP-13-03-02.
- Редкол.:Кнунянц И. Л. (гл. ред.). Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 249. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8.
- Materials Handbook: A Concise Desktop Reference, François Cardarelli, 2000, с.157.
- Венецкий С.И. Сорок первый // Рассказы о металлах. — Москва: Металлургия, 1979. — 240 с. — 60 000 экз.
- J.P. Riley and Skirrow G. Chemical Oceanography V. I, 1965
- Редкий ниобий на редкоземельном рынке
- Месторождение ниобия и тантала
- Larry D. Cunningham. USGS Minerals Information: Niobium (Columbium) and Tantalum. Minerals.usgs.gov (5 апреля 2012). Проверено 17 августа 2012. Архивировано 25 ноября 2012 года.
- Запуск коллайдера//«Наука и технологии России»
- Ниобиевые монеты: очарование цвета. Euro-Coins.News. Проверено 12 марта 2012. Архивировано 28 мая 2012 года.
- Каталог коллекционных монет Австрии из драгоценных металлов. Мир монет. Проверено 19 марта 2012. Архивировано 21 мая 2012 года.
- Для этого используется также титан в тех же количествах.
- Coin of time
- Coin of time2
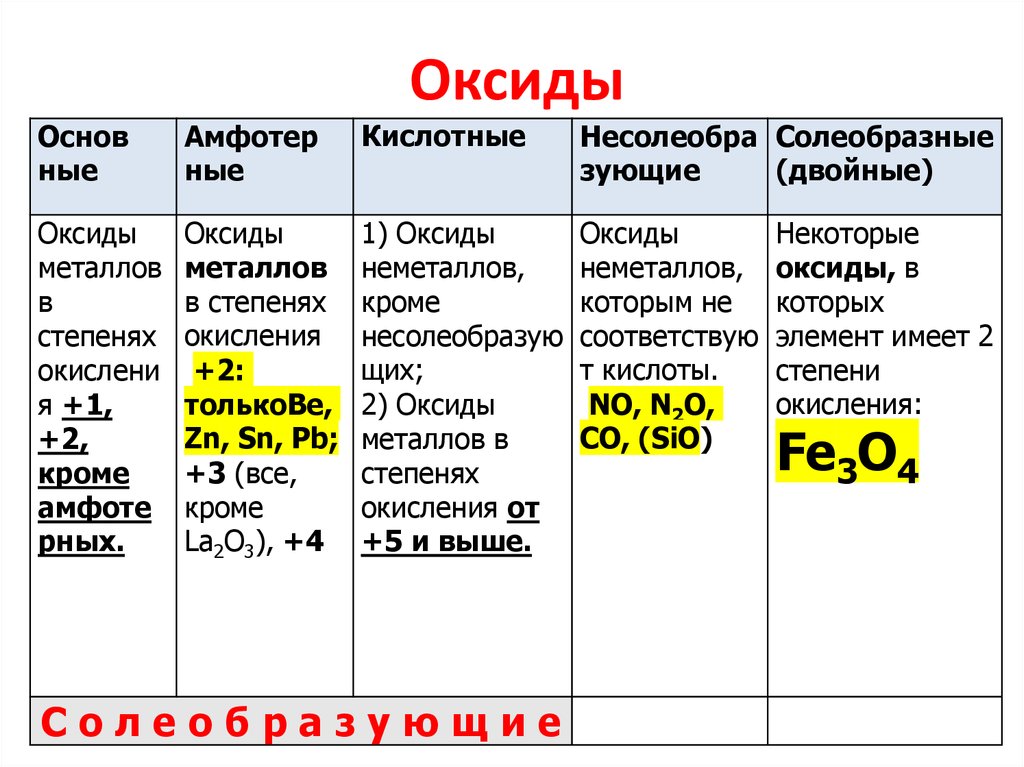
«Оксиды (названия, классификация, получение)»
Ключевые слова конспекта: оксиды, названия оксидов, классификация оксидов, получение оксидов, химические свойства.
Оксиды — сложные вещества, молекулы которых состоят из атомов двух химических элементов, один из которых — кислород. Атом кислорода в оксидах всегда имеет степень окисления –2.
К примеру, оксидом является соединение P2O5. А вот РН3 и H3PO4 — не являются оксидами, потому что в состав РН3 не входит атом кислорода, а в состав H3PO4 входят атомы трёх химических элементов, а не двух.
Оксиды подразделяют на солеобразующие (основные, кислотные, амфотерные) и несолеобразующие (безразличные). Особое положение у оксида «вода».
Названия оксидов
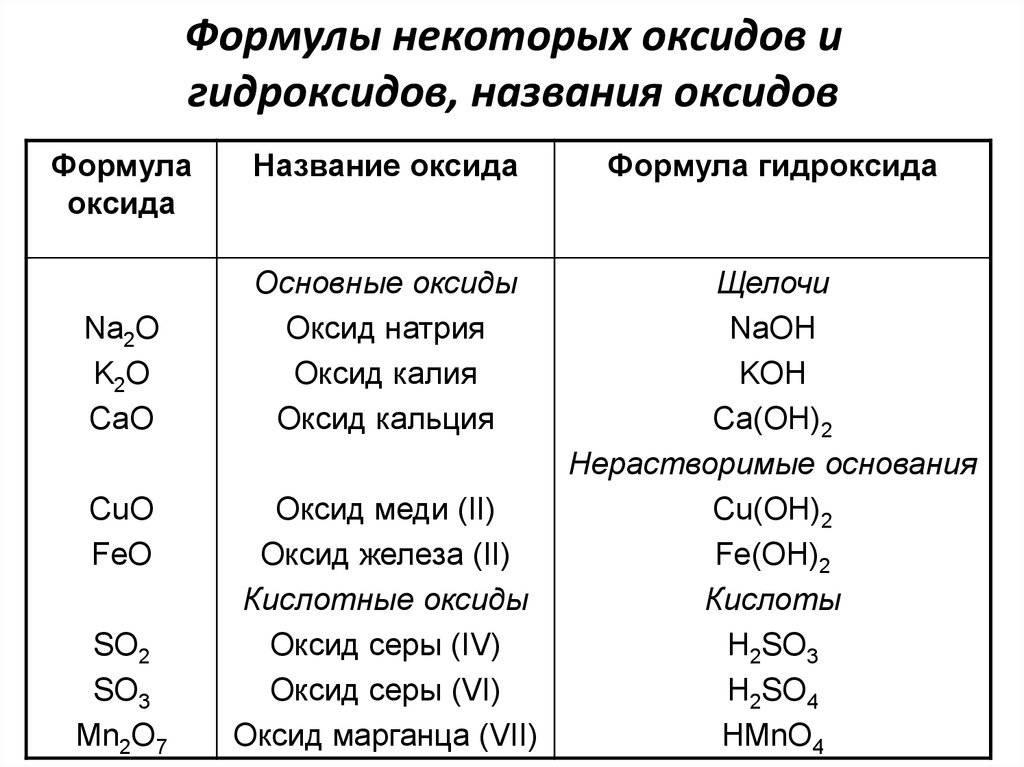
Названия оксидов состоят из двух слов: 1-е – «оксид», 2-е – название элемента в родительном падеже. Например, СаО – оксид кальция.
Если оксид образован химическим элементом с переменной валентностью, то после названия элемента, нужно указать его валентность. Например: Fe2О3— оксид железа (III), FеО — оксид железа (II). Если у элемента постоянная валентность, то ее не обозначают в названии.
Некоторые оксиды имеют особые (тривиальные) названия: Н2О — вода, СО — угарный газ, СО2 — углекислый газ и др.

Если элемент образует оксиды в нескольких степенях окисления, то оксид с наименьшей валентностью – низший оксид, а с наибольшей – высший оксид. Так, оксид хрома (II) СгО – низший оксид, а оксид хрома (VI) СгO3 – высший оксид.
Классификация оксидов
Многие оксиды могут реагировать с кислотами или основаниями. Продуктами таких реакций являются соли. Поэтому такие оксиды называются солеобразующими.
Однако существует небольшая группа оксидов, которые к таким реакциям не способны. Такие оксиды называются несолеобразующими (безразличными): H2O, CO, N2O, NO, F2O. Безразличные оксиды образуются только неметаллами.

Вот некоторые правила образования солеобразующих оксидов:
- неметаллы образуют только кислотные оксиды;
- металлы могут образовывать разные оксиды — основные, амфотерные, кислотные — в зависимости от валентности металла.
Предсказать свойства оксида металла может помочь эта схема.

Основные оксиды металлов от кислотных оксидов металлов отличить легко: малая валентность металла — основный оксид; большая — кислотный. Валентность металлов в амфотерных оксидах — III. Но есть и исключения. Поэтому желательно запомнить формулы наиболее часто встречающихся амфотерных оксидов.
Схема определения типа оксида:
- определить, не является ли данный оксид несолеобразующим;
- определить, какой элемент входит в состав оксида: металл или неметалл, для чего нужно знать из таблицы Менделеева символы элементов — неметаллов.
- если в состав оксида входит атом неметалла — то оксид кислотный;
- для атома металла определить валентность, и по схеме определить характер оксида: основный, амфотерный или кислотный.
Например:
- Сг2О3 — амфотерный, так как хром — металл с низкой валентностью III;
- N2O3 — кислотный оксид, так как азот — неметалл;
- CrO3 — кислотный оксид, так как хром — металл с высокой валентностью VI.
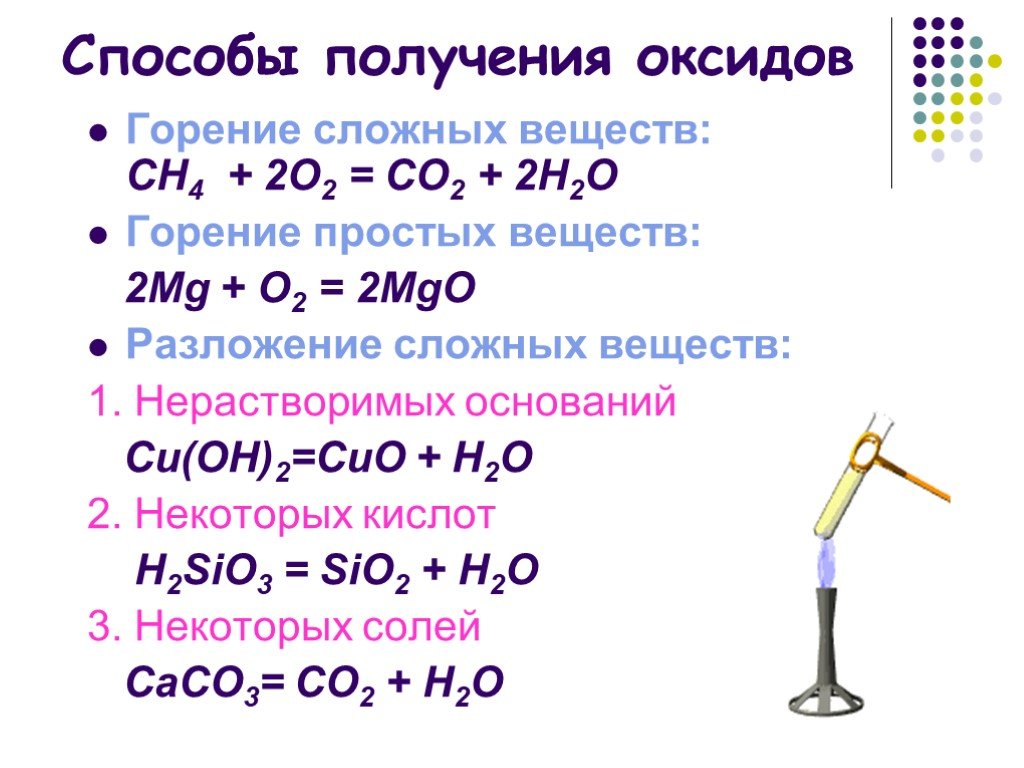
Получение оксидов
Oксиды образуются при взаимодействии простых и сложных веществ с кислородом:4Аl + 3O2 = 2Аl2O3; Si + O2 = SiO2;SiH4 + 2O2 = SiO2 + 2Н2O; 2Н2S + 3O2 = 2SO2 + 2Н2O.
В реакциях с простыми веществами из одних оксидов могут получаться другие оксиды:Fe2O3 + С = 2FeO + СО; 2CuO + Н2 = Сu2O + Н2O.
Oксиды образуются при разложении некоторых сложных веществ, обычно при нагревании:СаСO3 = СаО + СO2; 2Аl(ОН)3 = Аl2O3 + 3Н2O.
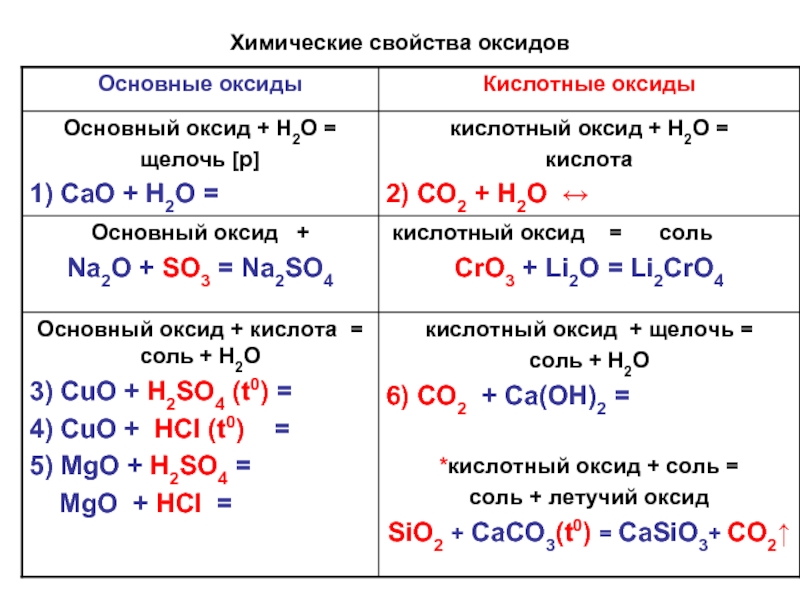
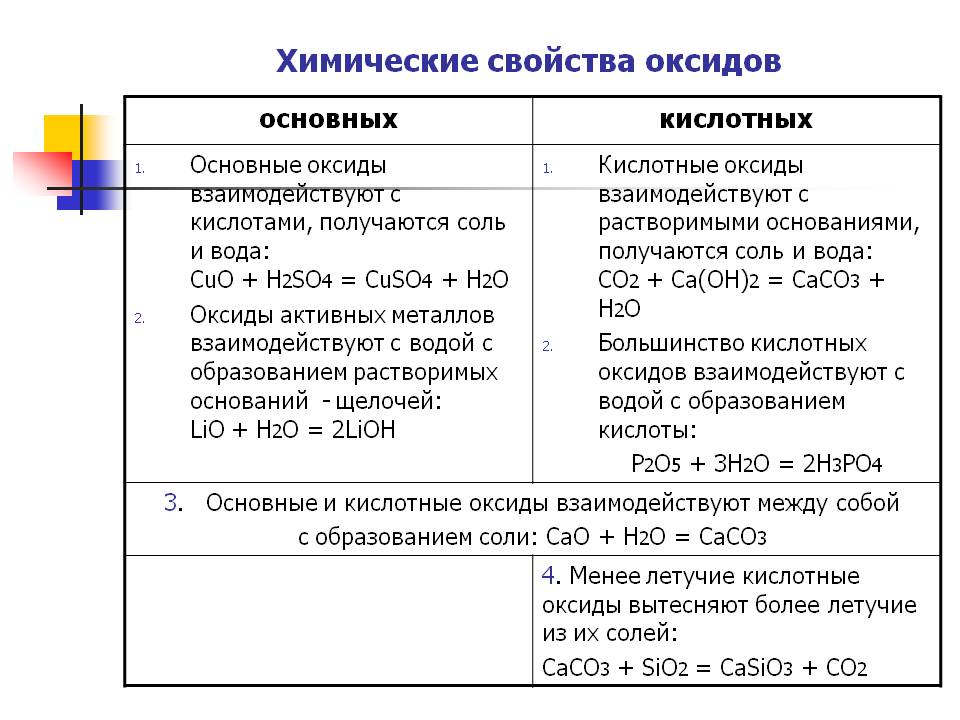
Химические свойства оксидов
3. Некоторые oксиды металлов и неметаллов реагируют с водой:СаО + Н2O = Са(ОН)2, SO3 + Н2O = Н2SO4.
4. Oксиды металлов обычно реагируют с оксидами неметаллов:СаО + SO2 = CaSO3, MgO + СO2 = MgCO3.
Реакции оксидов с основаниями, кислотами и солями будут рассмотрены позже.

Конспект урока «Оксиды (названия, классификация, получение, свойства)».
Следующая тема: «Свойства солеобразующих оксидов».
Свойства неметаллических оксидов

Свойства оксидов металлов варьируются в зависимости от металла и того, как он взаимодействует с анионом О2-. Это влечет за собой то, что некоторые оксиды имеют более высокую плотность или растворимость в воде, чем другие. Однако все они имеют общий металлический характер, что неизбежно отражается на его основности..
Другими словами: они также известны как основные ангидриды или основные оксиды.
основность
Основность оксидов металлов может быть проверена экспериментально с использованием кислотно-основного индикатора. Как? Добавление небольшого куска оксида в водный раствор с небольшим количеством растворенного индикатора; это может быть сжиженный сок фиолетовой капусты.
Имея диапазон цветов в зависимости от pH, оксид превратит сок в голубоватый цвет, соответствующий базовому pH (со значениями от 8 до 10). Это потому, что растворенная часть оксида высвобождает ионы ОН- к окружающей среде, будучи в эксперименте ответственными за изменение pH.
Таким образом, для оксида МО, который растворяется в воде, он превращается в гидроксид металла («гидратированный оксид») в соответствии со следующими химическими уравнениями:
МО + Н2O => M (OH)2
М (ОН)2 M2+ + 2OH-
Второе уравнение представляет собой баланс растворимости гидроксида М (ОН)2
Обратите внимание, что металл имеет заряд 2+, что также означает, что его валентность равна +2. Валентность металла напрямую связана с его тенденцией к получению электронов
Таким образом, чем позитивнее валентность, тем выше ее кислотность. В случае, когда М имел валентность +7, тогда оксид М2О7 это было бы кислым и не основным.
амфотерность
Оксиды металлов являются основными, однако не все имеют одинаковый металлический характер. Как узнать? Расположение металла М в периодической таблице. Чем больше он находится слева от него и в более низкие периоды, тем более металлическим он будет и, следовательно, более основным будет его оксид.
На границе между основными и кислотными оксидами (неметаллическими оксидами) находятся амфотерные оксиды. Здесь слово «амфотерный» означает, что оксид действует и как основание, и как кислота, что так же, как в водном растворе, он может образовывать гидроксид или водный комплекс М (ОН2)62+.
Водный комплекс – не более чем координация N молекулы воды с металлическим центром М. Для комплекса М (ОН2)62+, металл М2+ Он окружен шестью молекулами воды и может рассматриваться как гидратированный катион. Многие из этих комплексов проявляют интенсивную окраску, такую как наблюдаемая для меди и кобальта.
Химические свойства
Химически ниобий довольно устойчив, но уступает в этом отношении танталу. На него практически не действуют соляная, ортофосфорная, разбавленная серная, азотная кислоты. Металл растворяется в плавиковой кислоте HF, смеси HF и HNO3, концентрированных растворах едких щелочей, а также в концентрированной серной кислоте при нагревании свыше 150 °C. При прокаливании на воздухе окисляется до Nb2О5. Для этого оксида описано около 10 кристаллических модификаций. При обычном давлении стабильна β-форма Nb2O5.
- При сплавлении Nb2O5 с различными оксидами получают ниобаты: Ti2Nb10O29, FeNb49O124. Ниобаты могут рассматриваться как соли гипотетических ниобиевых кислот. Они делятся на метаниобаты MNbO3, ортониобаты M3NbO4, пирониобаты M4Nb2O7 или полиниобаты M2O·nNb2O5 (M — однозарядный катион, n = 2-12). Известны ниобаты двух- и трехзарядных катионов.
- Ниобаты реагируют с HF, расплавами гидрофторидов щелочных металлов (KHF2) и аммония. Некоторые ниобаты с высоким отношением M2O/Nb2O5 гидролизуются:
- 6Na3NbO4 + 5H2O = Na8Nb6O19 + 10NaOH.
- Ниобий образует NbO2, NbO, ряд оксидов, промежуточных между NbO2,42 и NbO2,50 и близких по структуре к β-форме Nb2О5.
- С галогенами ниобий образует пентагалогениды NbHal5, тетрагалогениды NbHal4 и фазы NbHal2,67 — NbHal3+x, в которых имеются группировки Nb3 или Nb2. Пентагалогениды ниобия легко гидролизуются водой.
- В присутствии паров воды и кислорода NbCl5 и NbBr5 образуют оксигалогениды NbOCl3 и NbOBr3 — рыхлые ватообразные вещества.
- При взаимодействии ниобия и графита образуются карбиды Nb2C и NbC, твёрдые жаропрочные соединения. В системе Nb — N существуют несколько фаз переменного состава и нитриды Nb2N и NbN. Сходным образом ведёт себя ниобий в системах с фосфором и мышьяком. При взаимодействии ниобия с серой получены сульфиды: NbS, NbS2 и NbS3. Синтезированы двойные фториды Nb и калия (натрия) — K2[NbF7].
- Из водных растворов выделить электрохимически ниобий пока не удалось. Возможно электрохимическое получение сплавов, содержащих ниобий. Электролизом безводных солевых расплавов может быть выделен металлический ниобий.
Область применения
По данным USGS (Геологическое обследование США), около 80 процентов Nb используется в сталелитейной промышленности для создания высокопрочных низколегированных сталей. Свойства ниобия позволяют применять его в сплавах, что повышает механическую и жаропрочность, ударную вязкость и коррозионную стойкость.
Другие области применения его включают строительство трубопроводов, суперсплавов для жаропрочного оборудования, а также реактивные двигатели и ювелирные изделия. Ниобий, вольфрам, молибден, тантал и рений известны как пять тугоплавких металлов. Все они обладают очень высокой устойчивостью к нагреву и износу.

Ниобий используется в сталелитейной промышленности
Промышленное использование Nb началось еще в начале 1900-х годов. Крупнейшим рынком ниобия (> 80%) является производство высокопрочной низколегированной стали, где он обеспечивает высокую жаропрочность и коррозионную стойкость для газопроводов, автомобильных компонентов и конструкционной стали.
Nb, как и тантал, позволяет переменному току проходить только в одном направлении через электролизер. Металл ниобий используется в дуговых сварочных стержнях для стабилизированных марок нержавеющей стали. Наиболее интересные его применения в области сверхпроводимости. Сверхпроводящие магниты изготовлены из проволоки Nb-Zr (ниобий и цирконий), которая сохраняет сверхпроводимость в сильных магнитных полях.
История
Чарльз Хэтчетт идентифицировал элемент колумбий в минерале, обнаруженном в Коннектикуте, США.
Изображение эллинистической скульптуры, изображающей Ниобу, работы Джорджо Соммера
Ниобий был идентифицирован английским химиком Чарльзом Хэтчеттом в 1801 году. Он обнаружил новый элемент в образце минерала, который был отправлен в Англию из Коннектикута , США в 1734 году Джоном Уинтропом FRS (внуком Джона Уинтропа Младшего ), и назвал минерал колумбитом. и новый элемент колумбий в честь Колумбия , поэтического названия Соединенных Штатов. Ниобий обнаружен Hatchett, вероятно , смесь нового элемента с танталом.
Впоследствии возникла значительная путаница по поводу разницы между колумбием (ниобием) и близким ему танталом. В 1809 году английский химик Уильям Хайд Волластон сравнил оксиды, полученные из колумбия-колумбита с плотностью 5,918 г / см 3 , и тантала- танталита с плотностью более 8 г / см 3 , и пришел к выводу, что эти два оксида, несмотря на значительная разница в плотности, были идентичны; таким образом он сохранил название тантал. Этот вывод был оспорен в 1846 году немецкий химик Генрих Розе , который утверждал , что существуют два различных элемента в образце танталит, и назвал их после того, как дети Тантала : ниобий (от Ниоба ) и pelopium (от Пелопсом ). Эта путаница возникла из-за минимальных наблюдаемых различий между танталом и ниобием. Заявленные новые элементы пелопий , ильмений и диан фактически идентичны ниобию или смесям ниобия и тантала.
Различия между танталом и ниобием были недвусмысленно продемонстрированы в 1864 году Кристианом Вильгельмом Бломстрандом и Анри Этьеном Сент-Клер Девиль , а также Луи Дж. Тростом , который определил формулы некоторых соединений в 1865 году и, наконец, швейцарским химиком Жаном Шарлем Галиссаром. де Мариньяк в 1866 году, который доказал, что существует только два элемента. Статьи об ильмении продолжали появляться до 1871 года.
Де Мариньяк первым подготовил металл в 1864 году, когда он восстановил хлорид ниобия, нагревая его в атмосфере водорода . Хотя де Marignac был способен производить тантал-ниобий бесплатно в большем масштабе 1866 г., он не был до начала 20 – го века , что ниобий был использован в лампы накаливания нити, первого коммерческого применения. Это использование быстро устарело из-за замены ниобия вольфрамом , который имеет более высокую температуру плавления. То, что ниобий улучшает прочность стали, было впервые обнаружено в 1920-х годах, и это применение остается его основным применением. В 1961 году американский физик Юджин Кунцлер и его коллеги из Bell Labs обнаружили, что ниобий-олово продолжает демонстрировать сверхпроводимость в присутствии сильных электрических токов и магнитных полей, что сделало его первым материалом, поддерживающим высокие токи и поля, необходимые для полезного высокого напряжения. силовые магниты и электрические машины . Это открытие позволило – два десятилетия спустя – производить длинные многожильные кабели, скрученные в катушки, для создания больших и мощных электромагнитов для вращающегося оборудования, ускорителей частиц и детекторов частиц.
Присвоение имени элементу
Колумбий (символ «Cb») – это название, которое Хатчетт дал после открытия этого металла в 1801 году. Название отражало, что типовой образец руды прибыл из Америки ( Колумбия ). Это название продолжало использоваться в американских журналах – последняя статья, опубликованная Американским химическим обществом с колумбием в названии, датируется 1953 годом, – в то время как ниобий использовался в Европе. Чтобы положить конец этой путанице, название ниобий было выбрано для элемента 41 на 15-й конференции Союза химиков в Амстердаме в 1949 году. Год спустя это название было официально принято Международным союзом чистой и прикладной химии (IUPAC) через 100 лет. противоречий, несмотря на хронологический приоритет названия Columbium . Это был своего рода компромисс; ИЮПАК принял вольфрам вместо вольфрама из уважения к использованию в Северной Америке; и ниобий вместо колумбия в соответствии с европейским использованием. Хотя многие химические общества и правительственные организации США обычно используют официальное название ИЮПАК, некоторые металлурги и общества металлургов все еще используют оригинальное американское название « колумбий .
Физические свойства ниобия
Металл серого цвета с белым оттенком. Относится к группе тугоплавких сплавов. Температура плавления составляет 2500 ºС. Точка кипения 4927 ºС. Отличается повышенным значением жаростойкости. Не теряет своих свойств при температурах работы свыше 900 ºС.
Механические характеристики также находятся на высоком уровне. Плотность составляет 8570 кг/м3 при аналогичном показателе стали 7850 кг/м3. Устойчив к работе как при динамических нагрузках, так и циклических. Предел прочности на разрыв – 34,2 кг/мм2. Обладает высокой пластичностью. Коэффициент относительного удлинения варьируется пределах 19-21%, что позволяет получать из него листовой прокат ниобия толщиной до 0,1 мм.
Твердость связана с чистотой металла от вредных примесей и повышается с увеличением их в составе. Чистый ниобий имеет 450 единиц шкалы твердости по Бринеллю.
Ниобий хорошо поддается обработке давлением при температурах ниже -30 ºС и плохо резанием.
Теплопроводность существенно не изменяется при больших колебаниях температуры. Например, при 20 ºС она составляет 51,4 вт/ (м К), а при 620 С повышается всего на 4 единицы. Ниобий конкурирует в электропроводности с такими элементами как медь и алюминий. Электросопротивление – 153,2 нОм м. Относится к категории сверхпроводящих материалов. Температура, при которой сплав переходит в режим сверхпроводника, составляет 9,171 К.
Крайне устойчив к воздействию кислой среды. Такие распространённые кислоты как серная, соляная, ортофосфорная, азотная никак не влияют на его химическую структуру.
При температурах свыше 250 ºС ниобий начинает активно окисляться кислородом, а также вступать в химические реакции с молекулами водорода и азота. Данные процессы увеличивают хрупкость металла, тем самым снижая его прочность.
- Не относится к аллергенным материалам. Внедренный в тело человека, он не вызывает реакции отторжения организмом.
- Является металлом первой группы свариваемости. Сварные швы получаются плотными и не требуют подготовительных операций. Устойчивые к образованию трещин.