§3. Вольфрамовая проволока
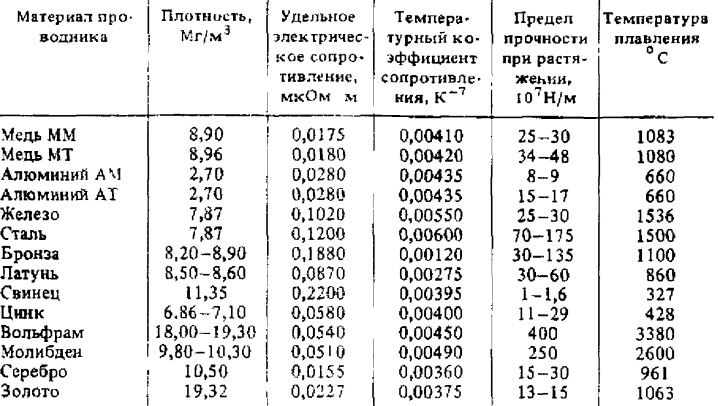
Производство Вольфрамовая проволока — один из самых распространенных видов продукции из данного тугоплавкого металла. Исходным материалом для ее изготовления являются кованые вольфрамовые прутки диаметром 2,75 мм.
Волочение проволоки производится при температуре 1000 °С в начале процесса и 400-600 °С — в конце. При этом нагревается не только проволока, но и фильера. Нагрев осуществляется пламенем газовой горелки или электрическим нагревателем.
Волочение проволоки диаметром до 1,26 мм ведут на прямолинейном цепном волочильном стане, в пределах диаметра 1,25-0,5 мм — на блочном стане с диаметром катушки ~1000 мм, диаметра 0,5-0,25 — на машинах однократного волочения.
В результате ковки и волочения структура заготовки превращается в волокнистую, которая состоит из осколков кристаллов, вытянутых вдоль оси обработки. Такая структура приводит к резкому повышению прочности проволоки из вольфрама.
После волочения вольфрамовая проволока покрыта графитовой смазкой. Поверхность проволоки необходимо очистить. Очистку производят с помощью отжига, химического или электролитического травления, электролитической полировки. Полировка может увеличить механическую прочность вольфрамовой проволоки на 20-25%.
Применение
Вольфрамовая проволока используется для изготовления элементов сопротивления в нагревательных печах, работающих в атмосфере водорода, нейтрального газа или в вакууме при температурах до 3000 °С. Также проволока из вольфрама служит для производства термопар. Для этого используются вольфрам-рениевый сплав с 5% рения и вольфрам-рениевый сплав с 20% рения (ВР 5/20). В ГОСТ 18903-73 “Проволока вольфрамовая. Сортамент” указаны области применения проволоки марок ВА, ВМ, ВРН, ВТ-7, ВТ-10, ВТ-15. Вольфрамовая проволока ВА в зависимости от группы, состояния поверхности и металла, диаметра применяется для изготовления спиралей ламп накаливания и других источников света, спиралеобразных катодов и подогревателей электронных приборов, пружин полупроводниковых приборов, петлевых подогревателей, неспиралеобразных катодов, сеток, пружин электронных приборов. Проволока марки ВРН применяется при получении вводов, траверсов и других деталей приборов, не требующих применения вольфрама со специальными присадками.
Карбиды вольфрама
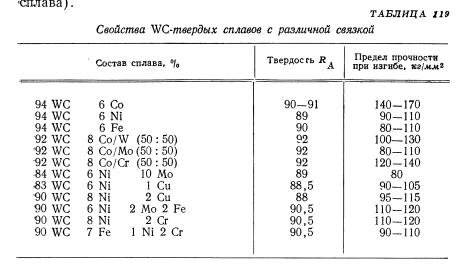
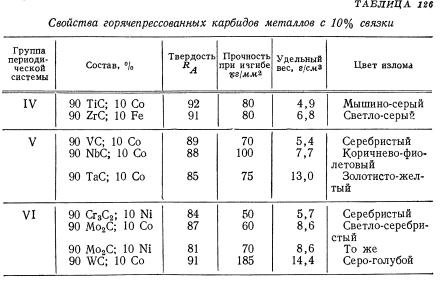
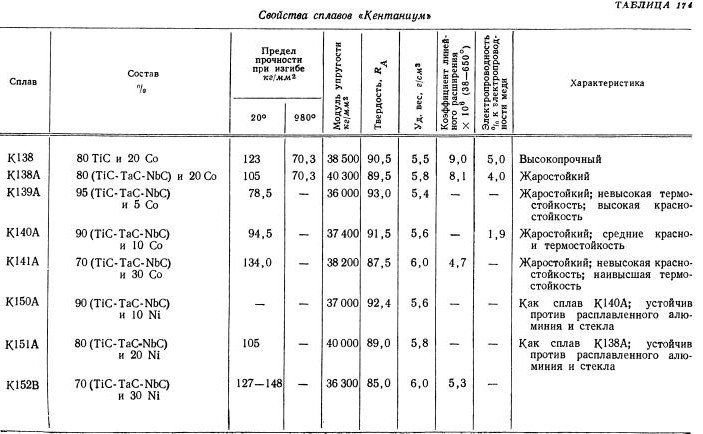
Твердые сплавы рассмотрим более подробно. Тугоплавкий металл может образовывать разные карбиды: полукарбид и монокарбид. Они отличаются способностью растворять в себе тугоплавкие металлы и взаимодействием с разными кислотами.
Вольфрам — металл имеющий разные карбиды
Также монокарбид уступает поликарбиду в устойчивости и твердости. А к преимуществам монокарбида можно отнести способность к образованию кристаллов в расплавленном вольфраме, что дает возможность использовать его в минералокерамических изделиях. Полукарбид обладает большей устойчивостью к температурам, легкостью внедрения в твердые растворы монокарбида с другими металлами (феррумом, кобальтом), повышенной износоустойчивостью.
Это интересно: Как правильно закалить нож в домашних условиях
История открытия
Рудокопы Саксонии в XIV-XVI вв. заметили, что после обработки оловянных руд остается много шлака. Работники в здешних копальнях называли его побочным продуктом, который «пожирает» олово, сравнивали с «волком, пожирающим овцу». Так и сформировалось название шлака «wolfrahm» («волчья пена» с немецкого языка).
Когда химик Карл Шееле обработал азотной кислотой «tungsten» («тяжелый камень» в переводе со шведского языка), удалось выделить новый метал, получивший такое же название. Событие произошло в 1781 г. Позже провели ряд анализов, которые показали, что шведскому химику удалось открыть не сам вольфрам, а его оксид. Поэтому минерал переименовали на «шеелит».
Через два года после открытия, сделанного Карлом Шееле, химики из Испании братья Элюар заявили, что смогли выделить из вольфрамита рудников Саксонии чистый вольфрам. Нужно отметить, что ни Шееле, ни братья Элюар не настаивали на том, что именно они стали первооткрывателями вольфрама.
До начала ХХ века химический элемент назывался «tungsten», его обозначали символом «Tu». Термин «вольфрам» и символ «W» был утвержден только в середине прошлого века.
Свойства карбидов вольфрама
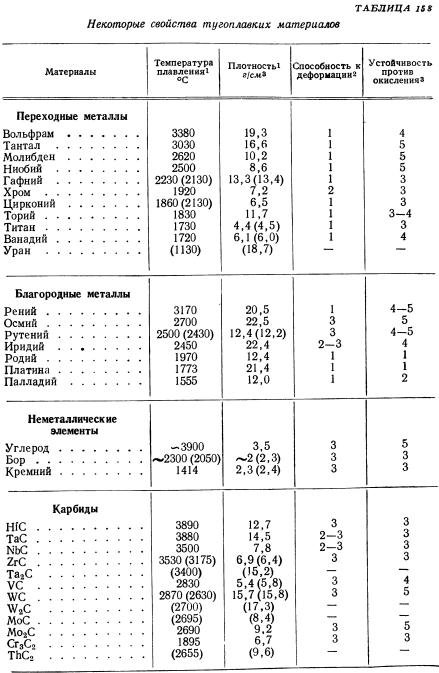
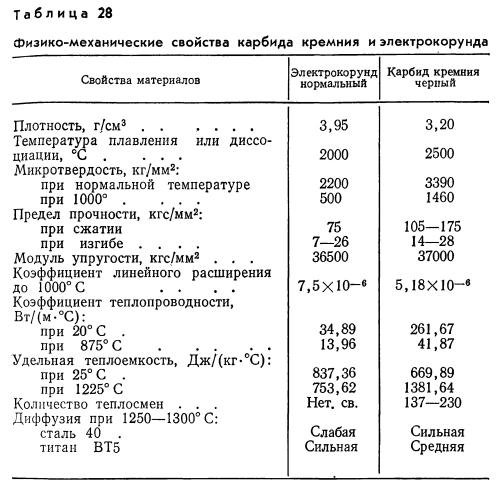
При высоких значениях температуры плавления, термостойкость карбидов вольфрама – достаточно низкая. Объясняется такое противоречие просто: кристаллическая структура и WC, и W2С – весьма жёсткая, поэтому термическое расширение практически отсутствует. С другой стороны карбид вольфрама обладает значительной теплопроводностью, причём для WC этот параметр с повышением температуры возрастает вдвое интенсивнее, чем у W2С.
Оптимальным диапазоном температур эксплуатации деталей, изготовленных из карбидов вольфрама, считается 200…3000С. С увеличением процентного содержания кобальта в твёрдых сплавах (до 20…25%) допустимые температуры эксплуатации возрастают до 700…8000С, превышая температуростойкость всех известных марок сталей (за исключением жаропрочных).
Карбиды вольфрама – соединения с хорошей электропроводностью, причём для WC этот показатель выше, чем у W2C, практически в 4 раза. Удельное электросопротивление карбидов вольфрама растёт при повышении температуры. Пропорционально этому, кстати, падают показатели упругости. Именно поэтому карбиды вольфрама хорошо обрабатываются электрофизическими методами: локальное введение высококонцентрированного источника тепла (дуга, искра, электрический импульс) повышает температуру в зоне обработки и способствует размерному разрушению структуры рассматриваемых соединений.
С точки зрения практического применения для карбидов вольфрама большее значение имеют их механические показатели – твёрдость и хрупкость. Получаемая в итоге микротвёрдость зависит в основном от температуры, при которой в вольфрамовом порошке формируются карбиды (менее — от степени их пористости). При повышении температуры дефекты в зёрнах залечиваются, поскольку возрастает подвижность атомов вольфрама и углерода. Поэтому конечная микротвёрдость соединений возрастает. При этом анизотропия свойств выражается значительно меньше, чем аналогичный показатель для металлов. Это упрощает предварительное ориентирование заготовки перед её обработкой.
Упругость карбидов вольфрама – максимальная для своего класса соединений тугоплавких металлов с углеродом, причём она возрастает с увеличением пористости
Это обстоятельство важно для изделий (в химсоставе которых присутствуют карбиды вольфрама), работающих в условиях знакопеременных нагрузок
Пластичность карбидов вольфрама крайне низка, и не превышает 0,015%.
Это интересно: Вулканизация резины — процесс, метод, температуна, технология
Нахождение в природе
Кларк вольфрама земной коры составляет (по Виноградову) 1,3 г/т (0,00013 % по содержанию в земной коре). Его среднее содержание в горных породах, г/т: ультраосновных — 0,1, основных — 0,7, средних — 1,2, кислых — 1,9.
Основная статья: Вольфрамовые руды
Вольфрам встречается в природе главным образом в виде окисленных сложных соединений, образованных трёхокисью вольфрама WO3 с оксидами железа и марганца или кальция, а иногда свинца, меди, тория и редкоземельных элементов. Промышленное значение имеют вольфрамит (вольфрамат железа и марганца nFeWO4 · mMnWO4 — соответственно, ферберит и гюбнерит) и шеелит (вольфрамат кальция CaWO4). Вольфрамовые минералы обычно вкраплены в гранитные породы, так что средняя концентрация вольфрама составляет 1—2 %.
Месторождения
Наиболее крупными запасами обладают Казахстан, Китай, Канада и США; известны также месторождения в Боливии, Португалии, России, Узбекистане и Южной Корее. Мировое производство вольфрама составляет 49—50 тысяч тонн в год, в том числе в Китае 41, России 3,5; Казахстане 0,7, Австрии 0,5. Основные экспортёры вольфрама: Китай, Южная Корея, Австрия. Главные импортёры: США, Япония, Германия, Великобритания.Также есть месторождения вольфрама в Армении и других странах.
Факторы здоровья
Поскольку вольфрам – редкий металл, а его соединения обычно инертны, влияние вольфрама на окружающую среду ограничено. Считается, что содержание вольфрама в земной коре составляет около 1,5 частей на миллион. Это один из самых редких элементов.
Поначалу считалось, что это относительно инертный и только слегка токсичный металл, но начиная с 2000 года вольфрамовые сплавы, его пыль и частицы могут вызвать рак и некоторые другие неблагоприятные эффекты как у животных, так и у людей. выделено из экспериментов in vitro и in vivo. Средняя летальная доза ЛД 50 сильно зависит от животного и способа введения и составляет от 59 мг / кг (внутривенно, кроликов) и 5000 мг / кг (металлического вольфрама порошок, внутрибрюшинные , крысы).
Люди могут подвергаться воздействию вольфрама на рабочем месте, вдыхая его, глотая, контактируя с кожей и глазами. Национальный институт профессиональной безопасности и здоровья (NIOSH) установила предел рекомендуемой экспозиции (REL) от 5 мг / м 3 в течение 8-часового рабочего дня и краткосрочного предела 10 мг / м 3 .
Вольфрам — самый тугоплавкий металл
Вольфрам — простое химическое вещество, элемент таблицы Менделеева, переходный металл. Записывается в виде латинской буквы W. Название получил от минерала вольфрамит, известного рудокопам с 16-го века. Сам минерал Wolf Rahm (в переводе с немецкого — «волчья пена») получил свое название из-за того, что осложнял получение олова из оловосодержащих пород. При выплавке примеси вольфрама образовывали соединения с оловом и поднимались на поверхность в виде пены; на языке рудокопов «пожирают олово как волк овцу».
Относится к редким элементам, по распространенности на планете занимает 57-е место. Встречается только в минералах, состоящих из соединений разных металлов. В добывающей индустрии наиболее значимы вольфрамит, шеелит, фербелит, гюбнерит. В месторождениях концентрация вольфрама редко превышает 2%.
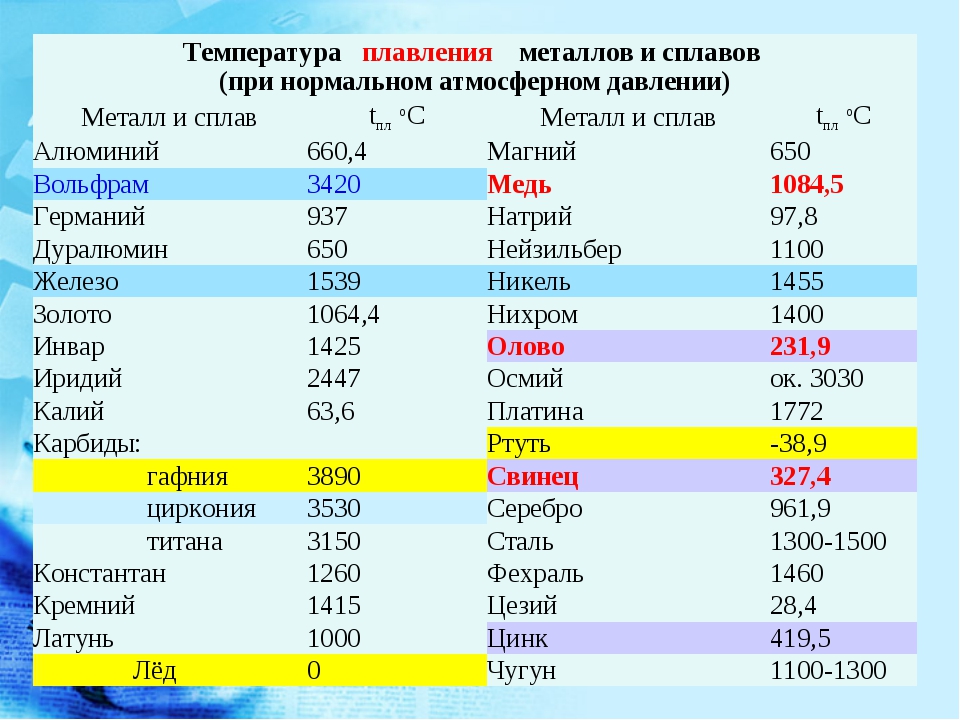
Как отдельный химический элемент вольфрам был открыт в конце XVIII века. Известный шведский химик К. Шееле проводил эксперименты с минералом тунгстен (позже переименованным в его честь и названным шеелитом). Обработав его азотной кислотой, ученый выяснил, что образец представляет собой соль неизвестной кислоты. Его ученики продолжили работы с интересным минералом и через два года настойчивых исследований выделили неизвестный науке металл, который назвали вольфрамом. Большого шума это открытие не вызвало, т.к. новый металл был чрезвычайно тугоплавким и в мире просто еще не существовало печей, способных обеспечить необходимую температуру для выплавки. Зато в ХХ веке вольфрам произвел в промышленности настоящую революцию.
|
|
| Электропечи с максимальной температурой нагрева +1300 °С | Электропечи с максимальной температурой нагрева +1100 °С |
Свойства
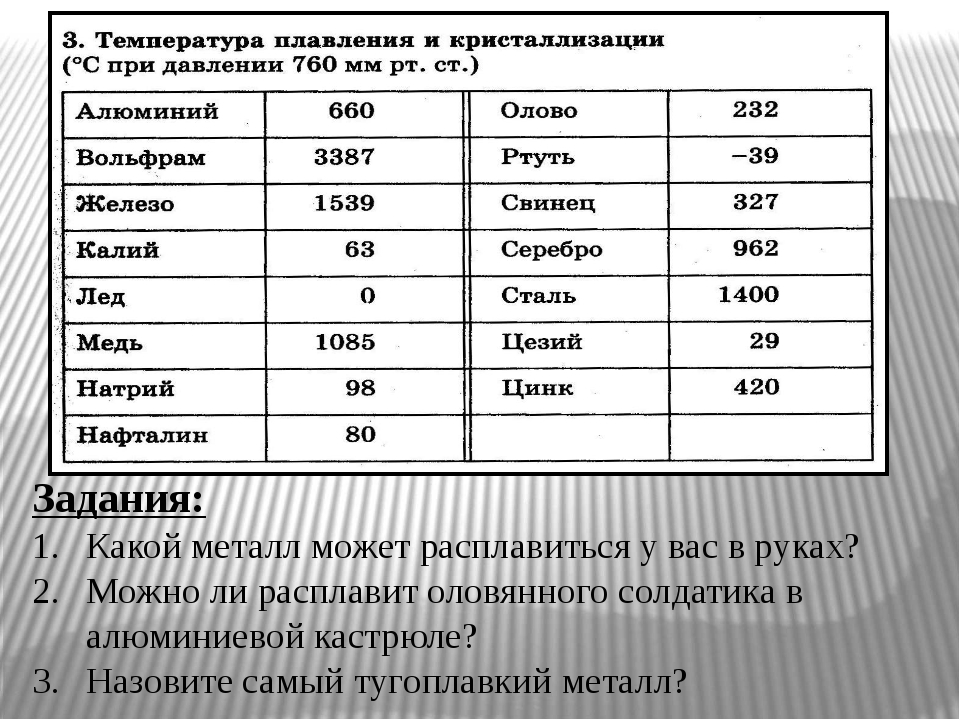
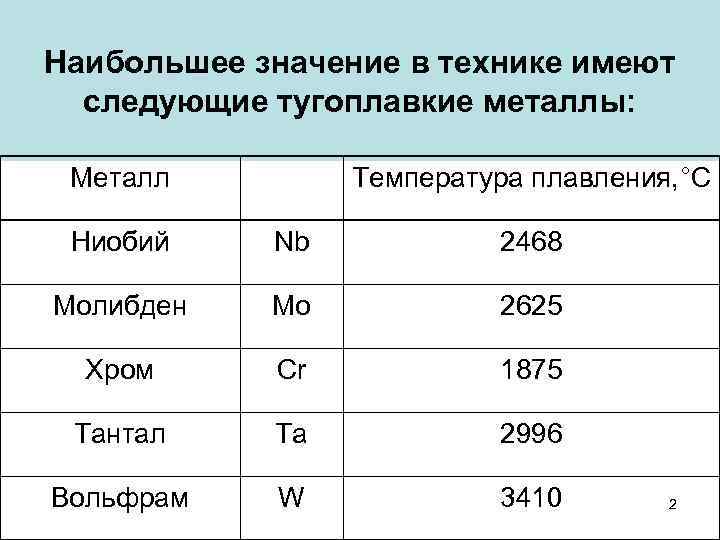
Светло-серебристый блестящий металл, напоминающий платину. Очень плотный, тяжелый, твердый, но, при этом, хрупкий. Плавится при t около +3400 °C, это самый высокий показатель среди металлов. (Теоретически более тугоплавким может быть трансактиноид сиборгий, но это короткоживущий радиоактивный элемент №106, получаемый искусственно в результате ядерного синтеза.) В нормальных условиях вольфрам плохо поддается механической обработке, зато при нагреве свыше +1600 °С его можно ковать, прокатывать, вытягивать в тонкую нить. Парамагнетик (может намагничиваться во внешнем магнитном поле), обладает высоким электрическим сопротивлением.
В химических реакциях может проявлять валентность от 2 до 6, но все устойчивые соединения образованы W (VI). При температуре в районе +20 °С не поддается коррозии в воде и на воздухе. Очень слабо реагирует с соляной, фтороводородной и неконцентрированной серной кислотами. А вот с перекисью водорода, азотной кислотой, смесью азотной и фтороводородной кислот, «царской водкой» взаимодействует легко. При высокой t и в присутствии окислителей вступает в реакции со щелочами. Образует оксиды, вольфраматы (соли вольфрамовых кислот), соединения с галогенами, серой, углеродом.
В метаболизме животных и человека не участвует.
Вольфрамовая пыль, как и пыль любого другого металла, оказывает раздражающее влияние на органы дыхания.
Это интересно
На Земле существует несколько типов архебактерий и бактерий, использующих в своих обменных процессах ферменты с вольфрамом. Ученые считают, что они ведут свое развитие с ранней архейской эры (около 4 млрд. лет назад), когда этот металл играл важную роль в создании и развитии жизни на планете.
Вольфрам — крайне востребованный в промышленности металл. Подробнее о его применении мы расскажем в следующей статье.
Получение
Существует несколько методов получения рассматриваемого соединения.
Первый — углеродное насыщение вольфрама. В результате на поверхности вольфрамовых частиц образуется монокарбид. Из него диффундирует углерод, формируя слой полукарбидного состава.
Для данных работ применяют вольфрамовый порошок и сажу. Данные материалы смешивают в определенном соотношении, наполняют ими, утрамбовывая, емкости и ставят в печь. Во избежание окисления операцию производят в водородной среде, так как в результате взаимодействия данного элемента с углеродом при 1300°С формируется ацетилен. Рассматриваемая технология предполагает формирование карбида вольфрама преимущественно за счет углерода. Температурный режим определяется гранулометрическим составом порошка. Так, для мелкозернистого используется температурный интервал 1300 — 1350°С, для крупнозернистого — 1600°С. Длительность выдержки равна 1 — 2 ч. В завершении получается карбид вольфрама, представленный немного спекшимися блоками.

Вольфрам
Второй вариант — углеродное восстановление вольфрамового оксида с карбидизацией. Данный метод предполагает совмещение карбидизации и восстановления. Процесс идет в среде CO и водорода.
Кроме того, карбид вольфрама получают из газовой фазы путем осаждения. Такое производство предполагает разложение при 1000°С карбонила вольфрама.
Восстановление вольфрамовых соединений с карбидизацией. Данную операцию осуществляют путем нагрева в водородной среде смеси паравольфрамата аммония либо вольфрамового ангидрида и вольфрамовой кислоты при 850 — 1000°С.
Наконец, выращивают кристаллы данного соединения из расплава. При этом используют смесь из Co и 40% монокарбида. Ее расплавляют при 1600°С в тигле из оксида алюминия. После гомогенизации температуру постепенно (1 — 3°С/мин) снижают до 1500°С и выдерживают 12 ч. Далее материал охлаждают и в кипящей соляной кислоте растворяют матрицу.
Кроме того, большие монокристаллы (до 1 см) выращивают по методу Чохральского.
Открытие и история
Еще в XVI веке был известен такой минерал, как вольфрамит. Он был интересен тем, что при выплавке олова из руды его пена превращался в шлак и, конечно же, это мешало производству. С тех пор, вольфрамит стали называть «волчья пена» (с нем. Wolf Rahm). Название минерала перешло и на сам металл.

Шведский химик Шееле в 1781 году обрабатывал азотной кислотой металл шеелит. В процессе эксперимента у него получился жёлтый тяжёлый камень – оксид вольфрама (VI). Через два года братья Элюар (испанские химики) получили из саксонского минерала сам вольфрам в чистом виде.
Добывают этот элемент и его руды в Португалии, Боливии, Южной Корее, России, Узбекистане, а наибольшие запасы были найдены в Канаде, США, Казахстане и Китае. В год добывается всего 50 тонн этого элемента, поэтому он дорого стоит. Рассмотрим подробнее, что за металл вольфрам.
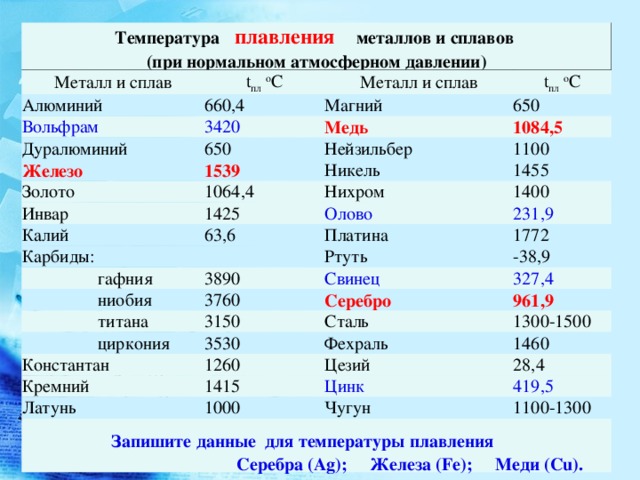
Свойства вольфрама (таблица): температура, плотность, давление и пр.:
| 100 | Общие сведения | |
| 101 | Название | Вольфрам |
| 102 | Прежнее название | |
| 103 | Латинское название | Wolframium |
| 104 | Английское название | Tungsten |
| 105 | Символ | W |
| 106 | Атомный номер (номер в таблице) | 74 |
| 107 | Тип | Металл |
| 108 | Группа | Переходный металл |
| 109 | Открыт | Карл Вильгельм Шееле, Швеция, 1781 г., Хуан Хосе Эльхуяр Любизе и Фаусто де Эльхуяр, Испания, 1783 г. |
| 110 | Год открытия | 1783 г. |
| 111 | Внешний вид и пр. | Твёрдый, тугоплавкий, блестящий серебристо-серый металл |
| 112 | Происхождение | Природный материал |
| 113 | Модификации | |
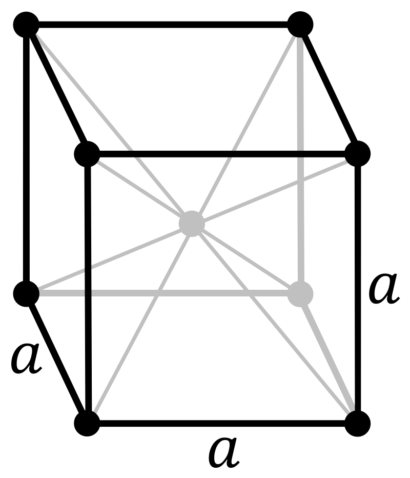
| 114 | Аллотропные модификации | 2 аллотропные модификации: – α-вольфрам с кубической объёмно-центрированной кристаллической решёткой, – β-вольфрам с кубической кристаллической решёткой, именуемой фаза А15 |
| 115 | Температура и иные условия перехода аллотропных модификаций друг в друга | |
| 116 | Конденсат Бозе-Эйнштейна | |
| 117 | Двумерные материалы | |
| 118 | Содержание в атмосфере и воздухе (по массе) | 0 % |
| 119 | Содержание в земной коре (по массе) | 0,00011 % |
| 120 | Содержание в морях и океанах (по массе) | 1,2·10-8 % |
| 121 | Содержание во Вселенной и космосе (по массе) | 5,0·10-8 % |
| 122 | Содержание в Солнце (по массе) | 4,0·10-7 % |
| 123 | Содержание в метеоритах (по массе) | 0,000012 % |
| 124 | Содержание в организме человека (по массе) | |
| 200 | Свойства атома | |
| 201 | Атомная масса (молярная масса) | 183,84(1) а. е. м. (г/моль) |
| 202 | Электронная конфигурация | 1s2 2s2 2p6 3s2 3p6 3d10 4s2 4p6 4d10 4f14 5s2 5p6 5d4 6s2 |
| 203 | Электронная оболочка | K2 L8 M18 N32 O12 P2 Q0 R0
|
| 204 | Радиус атома (вычисленный) | 193 пм |
| 205 | Эмпирический радиус атома* | 135 пм |
| 206 | Ковалентный радиус* | 162 пм |
| 207 | Радиус иона (кристаллический) | W4+ 80 (6) пм, W5+ 76 (6) пм, W6+ 74 (6) пм (в скобках указано координационное число – характеристика, которая определяет число ближайших частиц (ионов или атомов) в молекуле или кристалле) |
| 208 | Радиус Ван-дер-Ваальса | |
| 209 | Электроны, Протоны, Нейтроны | 74 электрона, 74 протона, 110 нейтронов |
| 210 | Семейство (блок) | элемент d-семейства |
| 211 | Период в периодической таблице | 6 |
| 212 | Группа в периодической таблице | 6-ая группа (по старой классификации – побочная подгруппа 6-ой группы) |
| 213 | Эмиссионный спектр излучения | |
| 300 | Химические свойства | |
| 301 | Степени окисления | -4, -2, -1, 0, +1, +2, +3, +4, +5, +6 |
| 302 | Валентность | II, III, IV, V, VI |
| 303 | Электроотрицательность | 2,3 (шкала Полинга) |
| 304 | Энергия ионизации (первый электрон) | 758,76 кДж/моль (7,86403(10) эВ) |
| 305 | Электродный потенциал | W3+ + 3e– → W, Eo = +0,11 В, W6+ + 6e– → W, Eo = +0,68 В |
| 306 | Энергия сродства атома к электрону | 78,6 кДж/моль |
| 400 | Физические свойства | |
| 401 | Плотность* | 19,3 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело), 17,6 г/см3 (при температуре плавления 3422 °C и иных стандартных условиях, состояние вещества – жидкость) |
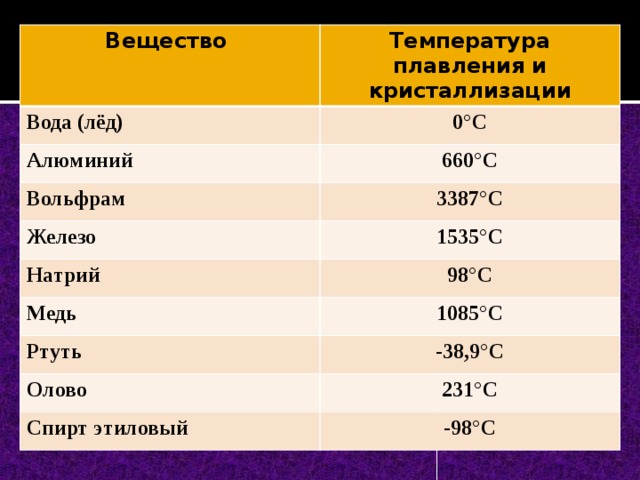
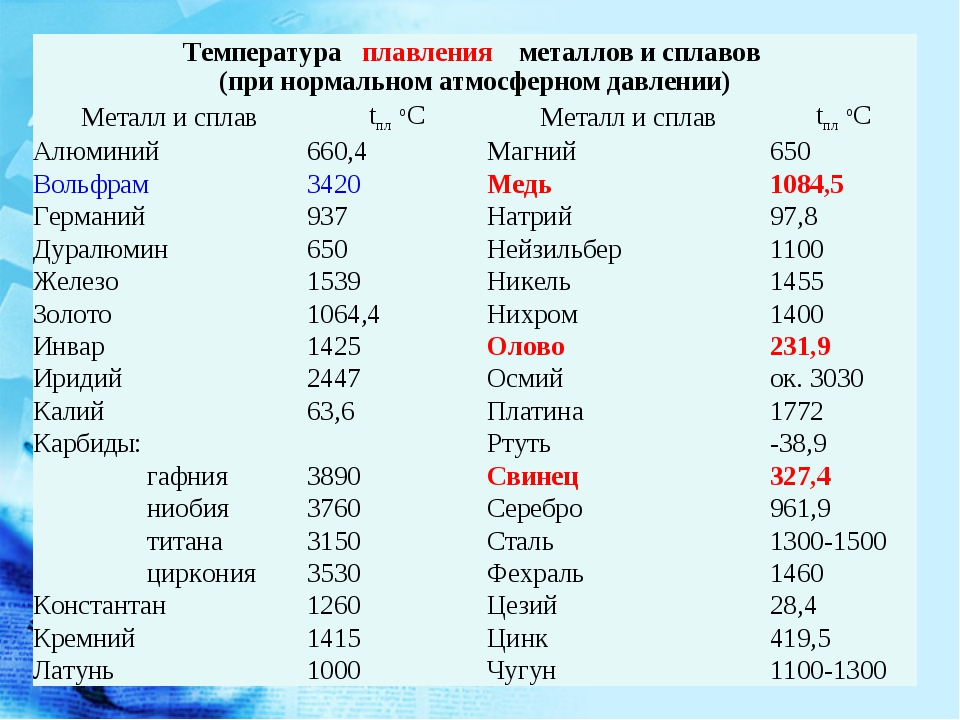
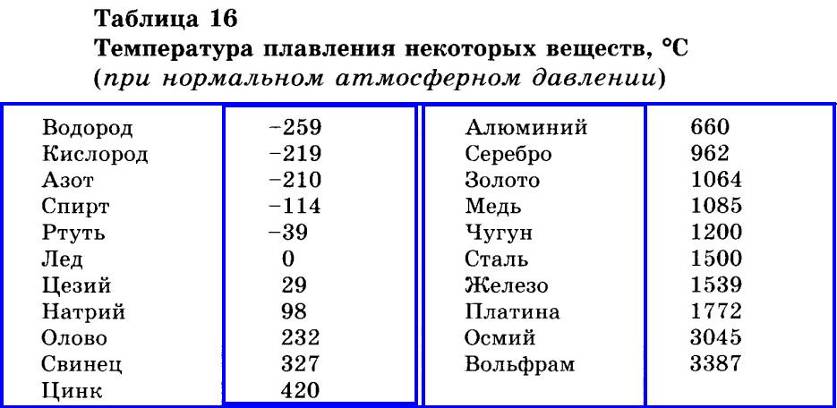
| 402 | Температура плавления* | 3422 °C (3695 K, 6192 °F) |
| 403 | Температура кипения* | 5930 °C (6203 K, 10706 °F) |
| 404 | Температура сублимации | |
| 405 | Температура разложения | |
| 406 | Температура самовоспламенения смеси газа с воздухом | |
| 407 | Удельная теплота плавления (энтальпия плавления ΔHпл)* | 52,31 кДж/моль |
| 408 | Удельная теплота испарения (энтальпия кипения ΔHкип)* | 774 кДж/моль |
| 409 | Удельная теплоемкость при постоянном давлении | 0,114 Дж/г·K (при 0-1000 °C) |
| 410 | Молярная теплоёмкость | 24,27 Дж/(K·моль) |
| 411 | Молярный объём | 9,53 см³/моль |
| 412 | Теплопроводность | 173 Вт/(м·К) (при стандартных условиях), 162,8 Вт/(м·К) (при 300 K) |
| 500 | Кристаллическая решётка | |
| 511 | Кристаллическая решётка #1 | α-вольфрам |
| 512 | Структура решётки | Кубическая объёмно-центрированная
|
| 513 | Параметры решётки | 3,160 Å |
| 514 | Отношение c/a | |
| 515 | Температура Дебая | 310 K |
| 516 | Название пространственной группы симметрии | Im_ 3m |
| 517 | Номер пространственной группы симметрии | 229 |
| 900 | Дополнительные сведения | |
| 901 | Номер CAS | 7440-33-7 |
Примечание:
205* Эмпирический радиус вольфрама согласно и составляет 139 пм и 137 пм соответственно.
206* Ковалентный радиус вольфрама согласно и составляет 162±7 пм и 170 пм соответственно.
401* Плотность вольфрама согласно и составляет 19,25 г/см3 (при 0 °C и иных стандартных условиях, состояние вещества – твердое тело) и 19,32 г/см3 (при 20 °C и иных стандартных условиях, состояние вещества – твердое тело) соответственно.
402* Температура плавления вольфрама согласно составляет 3420 °C (3693,15 K, 6188 °F).
403* Температура кипения вольфрама согласно и составляет 5555 °C (5828 K, 10031 °F) и 5680 °C (5953,15 K, 10256 °F) соответственно.
407* Удельная теплота плавления (энтальпия плавления ΔHпл) вольфрама согласно составляет 61,5 кДж/моль соответственно.
408* Удельная теплота испарения (энтальпия кипения ΔHкип) вольфрама согласно и составляет 824 кДж/моль и 769 кДж/моль соответственно.
Основные характеристики вольфрама
Для практического применения наиболее важны высокие показатели следующих характеристик:
электрическое сопротивление;
коэффициент линейного расширения;
температура плавления.
Чистый вольфрам обладает высокой пластичностью, не растворяется в специальном кислотном растворе без предварительного нагрева хотя бы до 5000С. Он легко вступает в реакцию с углеродом, следствием которой является образование карбида вольфрама известного высокой прочностью. Также металл известен своими оксидами, наиболее распространенный из них вольфрамовый ангидрид. Его главное преимущество над остальными, возможность восстановления порошка к состоянию компактного металла, с побочным образованием низших оксидов.

Режущие пластины фирмы Sandvik Coromant с применением карбида вольфрама
Среди основных характеристик, делающих применение вольфрама затруднительным называют следующие:
высокая плотность;
ломкость и склонность к окислению при низких температурах.
Кроме того, высокая температура кипения, а также точка испарения затрудняют добычу компактного материала.
§5. Вольфрамовые полосы (листы, ленты, фольга, пластины)
Производство Как правило, плоский прокат из вольфрама — листы , ленты , пластины, фольга — получают применением двух операций — плоская ковка и прокатка. В качестве заготовки используются вольфрамовые штабики различных размеров.
Сначала штабики из вольфрама подвергаются плоской ковке пневматическим молотом. Ковку ведут при температуре 1500-1700 °С, которая по мере деформации уменьшается до 1200-1300 °С. Операция ковки продолжается до получения поковки толщиной 8-10 мм (при сечении штабика 25х25 мм) или 4-5 мм (при сечении штабика 12х12 мм).
Затем полученные поковки подвергают прокатке на прокатных станах. В начале процесса прокатки заготовки нагревают до 1300-1400 °С, затем понижают температуру до 1000-1200 °С. С помощью горячей прокатки получают вольфрамовые листы, ленты и пластины толщиной до 0,6 мм. Для получения листов, лент и пластинок меньшего размера проводят холодную прокатку. Для получения тонких листов из вольфрама толщиной до 0,125 мм и ленты (фольги) толщиной 0,02-0,03 мм применяют прокатку в пакетах. Пакет состоит из нескольких вольфрамовых лент равной толщины и более толстых молибденовых пластин, которые лежат поверх лент из вольфрама. Молибденовые пластины более пластичны и быстрее деформируются, чем вольфрамовые. В результате во время прокатки они становятся тоньше, чем вольфрамовые ленты. Через один или несколько переходов молибденовые пластины приходится заменять новыми так, чтобы толщина пакета оставалась приблизительно постоянной. Стоит отметить, что целью данного процесса является изготовление именно тонкой вольфрамовой ленты (фольги). Молибденовые пластины здесь являются расходным материалом, который необходим для осуществления прокатки в пакетах.
Заготовками для вольфрамовой ленты, пластин и листов также могут служить слитки из вольфрама, которые получают методом плавки (см. Главу 2). Слитки предварительно прессуют. Из слитков диаметром 70-80 мм прессованием получают прямоугольные заготовки толщиной 20-25 мм и шириной 50-60 мм. Затем заготовки деформируют на двухвалковых прессах.
Вольфрамовые листы В-МП
Вольфрамовые листы В-МП получили широкое распространение в промышленности. Они производятся из порошка вольфрама марок ПВ1 и ПВ2, содержащего 99,98% W. Листы и пластины В-МП должны иметь толщину 0,5-45 мм, обрезанные кромки. Листы могут быть механически обработанны в соответствии с требованиями заказчика.ГОСТ 23922-79 “Листы из вольфрама марки В-МП. Технические условия”.Применение
Благодаря высокой жаропрочности вольфрамовые листы, как и другая продукция из данного тугоплавкого металла, применяются в условиях экстремально высоких температур. Из вольфрамовых листов изготавливается различная оснастка для высокотемпературных печей — тепловые экраны, подставки и другие элементы крепления. Распыляемые мишени из вольфрама, которые выполнены в виде пластин, используются для тонких барьерных пленок при металлизации полупроводниковых компонентов интегральных схем. В ядерной энергетике вольфрамовые листы используются в качестве экранов для ослабления потока радиоактивного излучения.
Структура
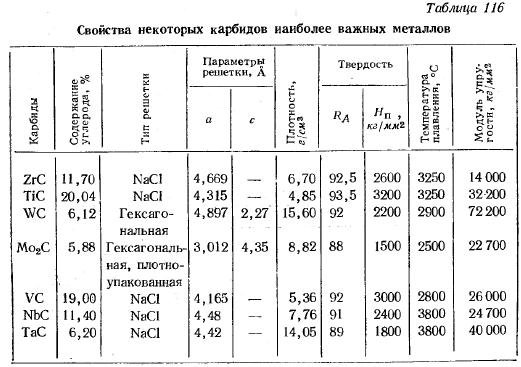
Структура α-WC, атомы углерода серые. Существуют две формы WC: гексагональная форма α-WC ( hP2 , пространственная группа P 6 м2, № 187) и кубическая высокотемпературная форма β-WC, имеющая структуру каменной соли . Гексагональную форму можно представить себе как состоящую из простой гексагональной решетки атомов металлов слоев, лежащих непосредственно друг над другом (т. Е. Не плотно упакованных), с атомами углерода, заполняющими половину пустот, придающих как вольфраму, так и углероду правильную тригонально-призматическую 6 координацию. . Из размеров элементарной ячейки можно определить следующие длины связей: расстояние между атомами вольфрама в гексагонально упакованном слое составляет 291 мкм, кратчайшее расстояние между атомами вольфрама в соседних слоях составляет 284 мкм, а длина углеродной связи вольфрама составляет 220 мкм. . Таким образом, длина связи вольфрам-углерод сравнима с одинарной связью в W ( CH 3 ) 6 (218 пм), в котором сильно искажена тригонально-призматическая координация вольфрама.
Молекулярный WC был исследован, и эта газовая фаза имеет длину связи 171 пм для 184 W 12 C .