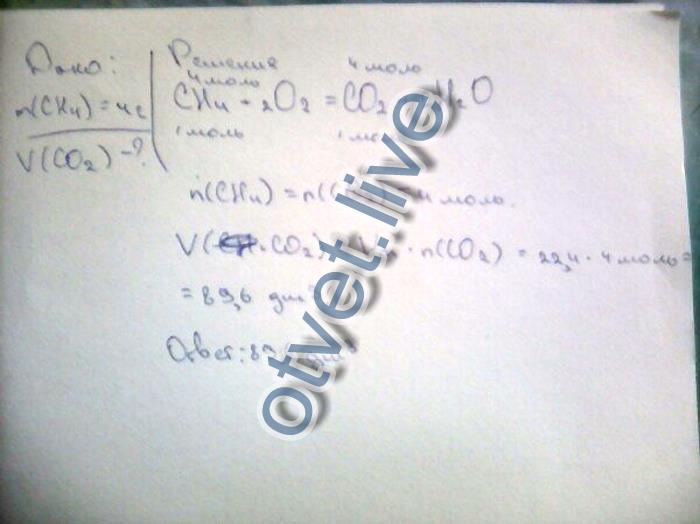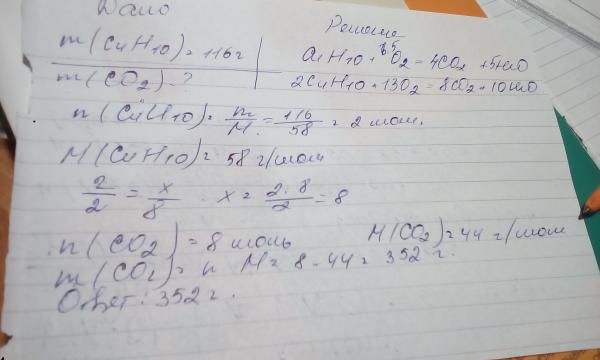Поглотители двуокиси углерода
Поглотителями называют любые искусственные или природные системы, которые впитывают из воздуха углекислый газ. Поглотитель — это структура, которая вбирает из воздуха больше CO2 чем выбрасывает в него.
Природные поглотители
Леса способны воздействовать на количество двуокиси углерода в воздухе. Они могут быть и поглотителями, и источниками выбросов параллельно (при вырубке). Когда деревья увеличиваются, а лес растет, то углекислый газ поглощается. Данный процесс считается основой развития биомассы. Выходит, что прогрессирующий лес выступает поглотителем.
 Лес северного полушария
Лес северного полушария
При сжигании и уничтожении леса основная доля накопленного углерода опять преобразуется в углекислый газ. В итоге лес снова является источником СО2.
Фитопланктон также является поглотителем углекислого газа на земле. При этом большая часть поглощенного углерода, передаваясь по пищевой цепочке, остается в океане.
Искусственные поглотители
Самыми известными поглотителями СО2 считаются: раствор едкого калия, натронная известь и асбест, едкий натр.
Эти соединения при протекании химических реакций связывают углекислоту, преобразовывая ее в другие соединения. Существуют установки, которые улавливают углекислый газ из выбросов электростанций и преобразуют его в жидкое или твердое состояние с последующим применением в промышленности. Производятся испытания закачки углекислого газа, растворенного в воде, в базальтовые породы под землей. В процессе реакции образуется твердый минерал.
 Станция закачки углекислого газа под землю
Станция закачки углекислого газа под землю
Свойства углекислого газа
В 17 веке Жан-Батист Ван Гельмонт из Фландрии открыл углекислый газ и определил его формулу. Подробное исследование и описание было сделано столетие спустя шотландцем Джозефом Блэком. Он исследовал свойства углекислого газа и провел серию опытов, в которых доказал, что он выделяется при дыхании животных.
В нормальных условиях не обладает вкусом, цветом и запахом. Только вдыхая большое его количество, человек ощущает кислый привкус. Его дает угольная кислота, образующаяся в малых дозах при растворении углекислого газа в слюне. Эта особенность применяется для приготовления газированных напитков. Пузырьки в шампанском, просекко, пиве и лимонаде — это и есть углекислый газ, образовавшийся в результате естественных процессов брожения или добавленный в напиток искусственно.

Физические свойства углекислого газа
Плотность углекислого газа больше плотности воздуха, поэтому при отсутствии вентиляции он скапливается внизу. Он не поддерживает окислительные процессы, такие, как дыхание и горение.
Поэтому углекислоту применяют в огнетушителях. Это свойство углекислого газа иллюстрируют с помощью фокуса — горящую свечу опускают в «пустой» стакан, где она и гаснет. В действительности стакан заполнен CO2.
Где используется углекислый газ
Углекислый газ находится не только в теле человека и в окружающей атмосфере. Многие промышленные производства активно используют химическое вещество на различных стадиях технологических процессов. Его применяют в качестве:
- стабилизатора;
- катализатора;
- первичного или вторичного сырья.
Двуокись кислорода способствует преобразованию винограда во вкусное терпкое домашнее вино. При брожении сахара, содержащегося в ягодах, выделяется углекислый газ. Он придает напитку игристость, позволяет ощутить лопающиеся пузырьки во рту. На упаковке продуктов питания двуокись углерода скрывается под кодом Е290. Как правило, она используется в качестве консерванта для длительного хранения. При выпечке вкусных кексов или пирогов многие хозяйки добавляют в тесто разрыхлитель. В процессе приготовления образуются пузырьки воздуха, делающие сдобу пышной, мягкой. Это и есть углекислый газ — результат химической реакции между гидрокарбонатом натрия и пищевой кислотой. Любители аквариумных рыбок используют бесцветный газ в качестве активатора роста водных растений, а производители автоматических углекислотных установок помещают его в огнетушители.

Углекислый газ, формула, молекула, строение, состав, вещество:
Углекислый газ (диоксид углерода, двуокись углерода, углекислота, оксид углерода (IV), угольный ангидрид) – бесцветный газ, почти без запаха (в больших концентрациях с кисловатым «содовым» запахом).
Углекислый газ – бинарное химическое соединение углерода и кислорода, имеющее формулу CO2.
Химическая формула углекислого газа CO2.
Строение молекулы углекислого газа, структурная формула углекислого газа:

Углекислый газ тяжелее воздуха приблизительно в 1,5 раза. Его плотность при нормальных условиях составляет 1,98 кг/м3, по отношении к воздуху – 1,524. Поэтому скапливается в низких непроветриваемых местах.
Концентрация углекислого газа в воздухе (в атмосфере Земли) составляет в среднем 0,046 % (по массе) и 0,0314 % (по объему).
Углекислый газ вырабатывается в органах и тканях человека образуется в качестве одного из конечных продуктов метаболизма. Он переносится от тканей по венозной системе и затем выделяется с выдыхаемым воздухом через лёгкие. Таким образом, содержание углекислого газа в крови велико в венозной системе, уменьшается в капиллярной сети лёгких, и содержание его мало в артериальной крови. В выдыхаемом человеком воздухе содержится около 4,5% диоксида углерода, что в 60-110 раз больше, чем во вдыхаемом. Организм человека выделяет приблизительно 1 кг углекислого газа в сутки.
Углекислый газ растворяется в воде. В 100 граммах воды растворяется 0,3803 грамма CO2 при 16 °C, 0,3369 грамма CO2 – при 20 °C, 0,2515 грамма CO2 – при 30 °C. Растворяясь в воде, образует угольную кислоту Н2CO3. Растворим также в ацетоне, бензоле, метаноле и этаноле.
Термически устойчив при температурах менее 1000 °C. При температуре 1000 °C восстанавливается углем до оксида углерода (II).
При нормальном атмосферном давлении диоксид углерода не существует в жидком состоянии, существует только в твердом или газообразном состоянии. Твердая двуокись углерода при повышении температуры не плавится, а переходит (возгоняется) непосредственно из твёрдого состояния в газообразное. Твёрдую двуокись углерода также называют сухим льдом. Внешний вид сухого льда напоминает обычный лед, снегоподобную массу. При сублимации сухой лед поглощает около 590 кДж/кг (140 ккал/кг) теплоты.
Под давлением 35 000 атм. твердая углекислота становится проводником электрического тока.
Жидкий углекислый газ можно получить при повышении давления. Так, при температуре 20 °С и давлении свыше 6 МПа (~60 атм.) газ сгущается в бесцветную жидкость. При нормальных условиях (20 °С и 101,3 кПа) при испарении 1 кг жидкой углекислоты образуется 509 л углекислого газа. Хранят и транспортируют углекислый газ, как правило, в жидком состоянии
Двуокись углерода негорюча, но в ее атмосфере может поддерживаться горение активных металлов, например, щелочных металлов и щелочноземельных – магния, кальция, бария.
Двуокись углерода нетоксична, невзрывоопасна.
Предельно допустимая концентрация двуокиси углерода в воздухе рабочей зоны не установлена, при оценке этой концентрации можно ориентироваться на нормативы для угольных и озокеритовых шахт, установленные в пределах 0,5% (об.) или 9,2 г/м (см. ГОСТ 8050-85 «Двуокись углерода газообразная и жидкая. Технические условия»).
По степени воздействия на организм человека двуокись углерода относится к 4-му классу опасности по ГОСТ 12.1.007-76.
При концентрациях более 5% (92 г/м) двуокись углерода оказывает вредное влияние на здоровье человека, так как она тяжелее воздуха в полтора раза и может накапливаться в слабопроветриваемых помещениях у пола и в приямках, а также во внутренних объемах оборудования для получения, хранения и транспортирования газообразной, жидкой и твердой двуокиси углерода. При этом снижается объемная доля кислорода в воздухе, что может вызвать явление кислородной недостаточности и удушья.
Углекислый газ образуется при гниении и горении органических веществ, в результате вулканической деятельности. Содержится в воздухе и минеральных источниках, выделяется при дыхании животных и растений. Искусственными источниками образования углекислого газа являются промышленные выбросы и выхлопные газы автомобильного транспорта.
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего участвует в процессе глобального потепления.
Симптомы воздействия углекислого газа
О том, что нормы СО2 в помещении (ppm) действительно влияют на самочувствие учащихся, проживающих и работающих, свидетельствуют многочисленные исследования, проводившиеся в странах Азии и Европы. Среди них:
- Индийские ученые из Калькутты определили, что СО2 – опасный токсин, в повышенной концентрации приводящий к биохимическим изменениям вплоть до клеточных мембран, а также провоцирующий ацидоз. Исследовали около 600 человек из промышленных районов и пригорода, и выяснили, что у тех, кто живет в загазованной атмосфере, в среднем на 60% выше уровень бикарбоната в сыворотке крови.
- Ученые Робертсон из Великобритании рассчитал, что неблагоприятные изменения в человеческом организме начинаются уже при содержании СО2 в пределах 426 ppm. Более существенные превышения провоцируют кратковременное перевозбуждение, непрекращающееся беспокойство и снижение желания проявлять физическую активность.
- Группа ученых из Финляндии во главе с Olli Seppanen задействовали в своем эксперименте более 30 тысяч человек и обнаружили, что в тех офисах, где концентрация углекислого газа не превышает 800ppm, люди работают с большей концентрацией внимания, реже жалуются на головную бол и меньше болеют респираторными инфекциями.
- В Италии ученые (члены Европейской комиссией DG SANCO в рамках программы «Health Effects of School Environment»), исследовали влияние СО2 на детей (эксперимент проводился в 2006 году) и выявили, что при превышении уровня в 1000ppm у детей в 2 раза выше риск появления ринита, а сухой кашель возникает в 3,5 раза чаще. Дети, которые долго находятся в загазованных помещениях, имеют более уязвимую носоглотку.
- Корейские специалисты исследовали связь между астмой и концентрацией углекислого газа в квартирах, где живут больные дети. Выяснилось, что содержание СО2 напрямую влияет на количество приступов.
- Аудиторская группа «KPMG» (Нидерланды) и ученые из Мидлсекского университетом (Великобритания) и провели эксперимент среди добровольцев – сотрудников офиса. Они доказали, что при превышении уровня в 800ppm внимательность снижалась на 30%, на уровне 1000ppm у людей начинались головные боли, Когда уровень достиг 1500ppm, то у большинства (80%) появилась усталость, а при 2000ppm 60% работников не смогли сосредоточиться на своих обычных действиях.
Все эти исследования так или иначе подтверждают: духота, головокружения, падение работоспособности и прочие симптомы общих недомоганий возникают не от недостатка О2, а от избытка СО2.
Влияние на атмосферу
Углекислый газ легко пропускает излучение в ультрафиолетовой и видимой частях спектра, которое поступает на Землю от Солнца и обогревает её. В то же время он поглощает испускаемое Землёй инфракрасное излучение и является одним из парниковых газов, вследствие чего предполагается, что он должен участвовать в процессе глобального потепления.
Изначально, до появления жизни, углекислый газ составлял основу атмосферы Земли и его уровень снижался от десятков процентов до долей одного в результате процесса фотосинтеза. Рост содержания углекислого газа до определённой концентрации приводит к появлению облаков из углекислоты, что ведет к похолоданию. Оба эти явления объясняют, почему температурные условия существования жизни на Земле относительно стабильны в течение миллиардов лет.
Характерные особенности углекислого газа

Двуокись углерода, угольный ангидрид, углекислый газ — газообразное химическое соединение, не обладающее цветом и запахом. Вещество в 1, 5 раза тяжелее воздуха, а его концентрация в атмосфере Земли составляет приблизительно 0,04 %. Отличительной особенностью углекислого газа является отсутствие жидкой формы при увеличении давления — соединение сразу переходит в твердое состояние, известное как «сухой лед». Но при создании определенных искусственных условий двуокись углерода принимает форму жидкости, что широко используется для ее транспортировки и длительного хранения.
В течение суток организм человека поглощает и метаболизирует около 1 кг двуокиси углерода. Она принимает активное участие в обмене веществ, который происходит в мягких, костных, суставных тканях, а затем попадает в венозное русло. С потоком крови углекислый газ поступает в легкие и покидает организм при каждом выдохе.
Химическое вещество находится в теле человека преимущественно в венозной системе. Капиллярная сеть легочных структур и артериальная кровь содержат небольшую концентрацию углекислого газа. В медицине используется термин «парциальное давление», характеризующий концентрационное соотношение соединения по отношению ко всему объему крови.
Определение выбросов загрязняющих веществ
Для оценки экологической нагрузки, генерируемой котельной, важно уметь рассчитывать объем выбросов в атмосферу разных типов вредных соединений. Нормативы удельных выбросов для котельных установок
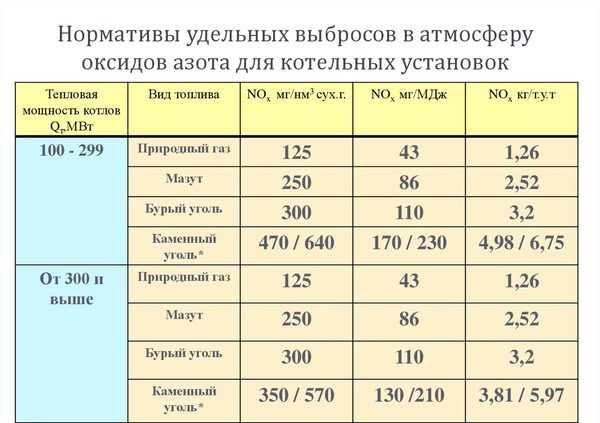
Нормативы удельных выбросов для котельных установок.
Газообразных
Рассчитать количество выбрасываемых в атмосферу окисей серы можно по такой формуле:
Mso2 = 20 * B * Sp (1-n’so2)(1-n»so2), в которой:
- В — расход использованного топлива, кг/с;
- Sp — процент серы в топливной массе;
- n»so2 — окиси в сыром золоуловителе;
- n’so2 — доля оксидов серы, связанных зольными соединениями внутри котлов.
Для окиси углерода формула будет иметь вид:
MCO = 10-3 * B * QpH *KCO (1-q4*0,01), в которой:
- В — расход топлива, г / с;
- QpH — наименьшая теплота сгорания;
- q4 — потери, связанные с неполным сгоранием;
- KCO — коэффициент образования окиси на единицу выделенного тепла, кг / Гдж (с неподвижной решеткой он будет равен 2 — для углей и 1 — для антрацитов).
Выбросы азотных оксидов при использовании твердого топлива в год вычисляют с помощью формулы:
MNO2 = Bp *QpH * KNO2 * βp* kп, и здесь:
- Bp — топливный расход;
- QpH — тепловая мощность котлов;
- KNO2 — удельный выход газа для сжигаемого топлива;
- βp — коэффициент, учитывающий влияние рециркуляции дыма на образование рассматриваемого газа (для твердотопливных систем он равен 1 — 0,075, где р — процент газовой рециркуляции);
- kп — коэффициент пересчета: при вычислении выбрасываемого газа в тоннах за год его берут равным 0,001.
Выбросы азотных оксидов.
Твердых
При использовании угольного топлива происходит выброс в воздух твердых частиц. К ним относятся топливо, не подвергшееся сгоранию, и летучие зольные соединения. Объемы таких выбросов, проникающих в атмосферу с дымовыми газами, в граммах в секунду можно вычислить таким образом:
Mтв =10* B(аун *Ар+q4 *QpH/32,68)(1-n3) , где
- аун — доля проникающих в атмосферу с газами зольных соединений;
- Ар — процент зольности используемого топлива;
- q4 — коэффициент потерь, связанных с неполным сгоранием (считать для бурых разновидностей и донецкого угля с коэффициентом, равным 6);
- n3 — выбросы в твердой форме, попадающие в золоуловитель (значение находится в пределах 75-85%).
Применение углекислого газа

Двуокись углерода чаще всего применяют:
- для создания защитной среды при сварке полуавтоматом;
- в производстве газированных напитков;
- охлаждение, замораживание и хранения пищевых продуктов;
- для систем пожаротушения;
- очистка сухим льдом от загрязнений поверхности изделий.
Применение углекислоты для сварки
Плотность углекислого газа достаточно высока, что позволяет обеспечивать защиту реакционного пространства дуги от соприкосновения с газами воздуха и предупреждает азотирование металла шва при относительно небольших расходах углекислоты в струе. Углекислый газ является активным газом, т.е. в процессе сварки он взаимодействует с металлом шва и оказывает на металл сварочной ванны окисляющее, а также науглероживающее действие.
В настоящее время ввиду большого разбрызгивания металла сварочной ванны при сварке в углекислоте все чаще применяют сварочные смеси с аргоном. Производители сварочного оборудования не остались в стороне от даной проблемы и предусматривают специальный режим на сварочных полуавтоматах, при котором уменьшается эффект разбрызгивания. Еще один путь решения данной проблемы – это применение специальных спреев или жидкостей, которые не позволяют прикипать брызгам к металлу свариваемой детали. В любом случае применение любого из данных методов с лихвой окупит затраты времени и расходных материалов на удаление брызг путем механической зачистки.
Ранее препятствием для применения углекислоты в качестве защитной среды являлось образование дефектов в швах в виде пор. Поры вызывались кипением затвердевающего металла сварочной ванны от выделения окиси углерода (СО) вследствие недостаточной его раскисленности.
При высоких температурах углекислый газ диссоциирует с образованием весьма активного свободного, одноатомного кислорода:
СO2=CO+O
Окисление металла шва выделяющимся при сварке из углекислого газа свободным кислородом нейтрализуется содержанием дополнительного количества легирующих элементов с большим сродством к кислороду, чаще всего кремнием и марганцем (сверх того количества, которое требуется для легирования металла шва) или вводимыми в зону сварки флюсами (полуавтоматическая сварка порошковой проволокой).
Как двуокись, так и окись углерода практически не растворимы в твердом и расплавленном металле. Свободный активный кислород окисляет элементы, присутствующие в сварочной ванне, в зависимости от их сродства к кислороду и концентрации по уравнению:
Мэ + О = МэО
где Мэ – металл (марганец, алюминий или др.).
Кроме того, и сам углекислый газ реагирует с этими элементами.
В результате этих реакций при сварке в углекислоте наблюдается значительное выгорание алюминия, титана и циркония, и менее интенсивное – кремния, марганца, хрома, ванадия и др.
Особенно энергично окисление примесей происходит при полуавтоматической сварке. Это связано с тем, что при сварке плавящимся электродом взаимодействие расплавленного металла с газом происходит при пребывании капли на конце электрода и в сварочной ванне, а при сварке неплавящимся электродом – только в ванне. Как известно, взаимодействие газа с металлом в дуговом промежутке происходит значительно интенсивнее вследствие высокой температуры и большей поверхности контактирования металла с газом.
Оценка выбросов CO2 на уровне компаний
Раскрывая информацию о политике и мероприятиях, направленных на сокращение выбросов парниковых газов, участие в решениях проблем изменения климата, сокращения лесов, а также ухудшения состояния водных ресурсов, как по количественным, так и качественным характеристикам, компании заявляют о своей открытости, о ведении бизнеса не только в соответствии с принципами экономической целесообразности, но и об уделении большого внимания устойчивому развитию и вопросам сохранения окружающей среды. Компании подтверждают, что их деятельность соответствует целям, установленным в Парижском соглашении по климату 2020 года.
Углекислый газ: хранение и транспортировка
Хранение СО осуществляется в баллонах чёрного цвета, на корпусе которых обязательно должна быть надпись «Углекислота».
Кроме этого, на ёмкости наносится маркировка, по которой можно получить информацию о производителе баллона, весе пустой ёмкости, а также узнать дату последнего освидетельствования. Нельзя использовать углекислотные баллоны, у которых:
- Истёк срок освидетельствования.
- Имеются повреждения.
- Неисправны вентили.
Транспортировка наполненных газом баллонов должна осуществляться по следующим правилам:
- Транспортировать ёмкости только в горизонтальном положении. Вертикальное размещение допускается только в том случае, если имеются специальные ограждения, которые препятствуют падению баллона во время перевозки.
- Для безопасного перемещения на баллонах должны быть резиновые кольца.
- Не допускать механических воздействий, а также чрезмерного нагрева.
- Запрещается перевозка углекислотных баллонов в торговых аппаратах.
Кроме этого, техникой безопасности запрещается переносить баллоны вручную или перекатывать их по земле.
Хранение баллонов с углекислотой может осуществляться как в специально оборудованных помещениях, так и под открытым небом. В зданиях ёмкости следует размещать на расстоянии не менее 1 метра от отопительных приборов. При хранении на улице необходимо оградить ёмкости от воздействия прямых солнечных лучей и осадков, поэтому размещать резервуары таким способом рекомендуется под навесом. Если хранение баллонов осуществляется в неотапливаемом помещении или под открытым небом, то в зимнее время необходимо следить за тем, чтобы ёмкости не охлаждались ниже минус 40 градусов Цельсия.
Основное применение
CO2 широко применяется в промышленности и в быту – в огнетушителях и для изготовления газировки, для охлаждения продуктов и для создания инертной среды при сварке.

Основное применение углекислого газа
Применение углекислого газа отмечено в таких отраслях, как:
для чистки поверхностей сухим льдом.
Фармацевтика
- для химического синтеза компонентов лекарственных средств;
- создания инертной атмосферы;
- нормализация индекса pH отходов производства.

Углекислый газ в фармацевтике
Пищевая отрасль
- производство газированных напитков;
- упаковка продуктов питания в инертной атмосфере для продления срока годности;
- декаффеинизация кофейных зерен;
- замораживание или охлаждение продуктов.

Углекислый газ в пищевой отрасли
Медицина, анализы и экология
- Создание защитной атмосферы при полостных операциях.
- Включение в дыхательные смеси в качестве стимулятора дыхания.
- В хроматографических анализах.
- Поддержание уровня pH в жидких отходах производства.

Углекислый газ и экология
Электроника
- Охлаждение электронных компонентов и устройств при тестировании на температурную стойкость.
- Абразивная очистка в микроэлектронике (в твердой фазе).
- Очищающее средство в производстве кремниевых кристаллов.
Химическая отрасль
Широко применяется в химическом синтезе в качестве реагента и в качестве регулятора температур в реакторе. CO2 отлично подходит для обеззараживания жидких отходов с низким индексом pH.

Использование углекислого газа
Применяется также для осушения полимерных веществ, растительных или животных фиброматериалов, в целлюлозном производстве для нормализации уровня pH как компонентов основного процесса, так и его отходов.
Металлургическая отрасль
В металлургии CO2 в основном служит делу экологии, защиты природы от вредных выбросов путем их нейтрализации:

Применение углекислого газа в металлургии
- В черной металлургии — для нейтрализации плавильных газов и для донного перемешивания расплава.
- В цветной металлургии при производстве свинца, меди, никеля и цинка — для нейтрализации газов при транспортировке ковша с расплавом или горячих слитков.
- В качестве восстановительного агента при организации оборота кислотных шахтных вод.
Сварка в углекислой среде

Процесс сварки с применением углекислого газа
Разновидность сварки под флюсом является сварка в углекислой среде. Операции сварочных работ с углекислым газом осуществляется плавящимся электродом и распространен в процессе монтажных работ, устранении дефектов и исправления деталей с тонкими стенками.
Заключение
Очень жаль, что система образования в наших странах не уделяет столь важного внимания для пересмотра учебников в школах и институтах. Полученные знания об углекислоте необходимо доводить со школьной скамьи до учащихся образовательных учреждений
Знания многих процессов, протекающих в организме с участием диоксида углерода, могли бы научить нас правильному питанию и ведению здорового образа жизни. Продление жизни нашего организма тесно связано с наличием углекислого газа в нем, поэтому применяя на практике полученные знания, мы бы могли обеспечить себе здоровую и долгую жизнь.